آب سنگین
آب سنگین
آب سنگین ،به يكي از اشکال نادر آب به نام دوتریُم اُكسايد (D2O) گفته ميشود كه در آن به جاي دو اتمِ هيدروژن معمولي (H)، دو اتم هيدروژن سنگين (D) قرار دارد. هيدروژن داراي 2 ايزوتوپ پايدارH و D و يك ايزوتوپ ناپايدار وراديواكتيوTيا تريتيُم است. تفاوت ایزوتوپهای مختلف یك عنصر از تفاوت در شمار نوترونهای موجود در هستۀ آنها ناشي ميشود؛ يعني با وجودي كه شمار پروتونهای موجود در هستۀ اتمهای همۀ ایزوتوپهای یک عنصر با هم برابر است، شمار نوترونها در ايزوتوپهاي مختلف یک عنصر متفاوت است. به عنوان مثال هسته ايزوتوپ معمولي هيدروژن (H) تنها داراي يك پروتون است و نوترون ندارد، در حالی که هسته دوتریم (D) داراي يك پروتون و يك نوترون است، و هسته تریتیمُ (T) دارای یك پروتون و دو نوترون است.
آب با اکسيژن سنگين
آب با اکسيژن سنگين، در حالت معمول با اکسیژن 18 است که به صورت تجارتي در دسترس است و بيشتر براي رديابي به کار برده ميشود. براي مثال، با جانشين کردن اين آب (با نوشيدن يا تزريق) در يکي از عضوهاي بدن ميتوان در طول زمان ميزان تغيير در مقدار آب اين عضو را بررسي کرد.
اين نوع از آب به ندرت حاوي دوتريوم است و به همين علت خواص شيميايي و بيولوژيکي خاصي ندارد براي همين، به آن آب سنگين گفته نميشود. ممکن است اکسيژن در آنها به صورت ايزوتوپهاي O17 نيز موجود باشد، در هر صورت تفاوت فيزيکي اين آب با آب معمولي، فقط چگالي بيشتر آن است و تفاوت دیگری با آب معمولی ندارد.
تفاوت آب سنگین و آب خالص
آب خالص یا همان آب سبک مادهای است بیرنگ، بیبو و بيمزه. فرمول شیمیایی آن H2Oاست، یعنی هر مولكول آب از پيوند دو اتم هیدروژن به یك اتم اكسیژن ساخته شده است. در حالیکه اگر در یک نمونه مولکول آب به جای اتم های هیدروژن آن، اتم دوتریم جایگزین شود آب سنگین ایجاد می شود.
یک نکته مهم در رابطه با این بحث آگاه بودن به تفاوت میان آب سنگین و آب سخت (آّبی که دارای املاح معدنی زیادی است) می باشد.
جالب است بدانید به ازای هر 7 هزار مولکول معمولی یک مولکول آب سنگین در آب مصرفی ما وجود دارد.
فرآیند تولید آب سنگین
گیلبرت لوییس براي اولين بار در سال 1933 به روش الكتروليز (برقکافت) به آب سنگينِ خالص دست يافتند. برای تولید آب سنگین خالص با روش الكترولیز به دستگاههای پیچیده تقطیر و الكترولیز و همچنین مقدار زیادی انرژی نیاز است، به همین دلیل بیشتر از روشهای شیمیایی برای تهیه آب سنگین استفاده میكنند.
همچنین از آنجایی که نقطه جوش آب سنگين بالاتر از آب معمولي است، میتوان براي توليد آبسنگین از روش تبخير و تقطير هم استفاده کرد. در طبیعت از هر ۳۲۰۰ مولکول آب یكی آب نیمه سنگین HDO (یک اتم دوتریم با یک اتم هیدروژن ) است.
آب نیمه سنگین را میتوان با روشهایی مانند تقطیر یا الكترولیز یا دیگر فرآیندهای شیمیایی از آب معمولی به دست آورد. هنگامی كه مقدار HDO در آب زیاد شد، میزان آب سنگین نیز بیشتر میشود، زیرا مولکولهای آب هیدروژنهای خود را با یكدیگر عوض میكنند و احتمال دارد كه از دو مولكول HDO یك مولکول آب معمولی (H2O) و یك مولکول آب سنگین (D2O) به وجود آید.
2HDO —> H2O + D2O
تفاوت جرمِ آب سنگين و آب سبك قابل ملاحظه است و تفاوت در نقاط جوش اين 2 نوع آب،امكان جداسازي آب سنگين و خالص سازي آن را فراهم مي كند. تأسيسات توليد آب سنگين اكنون فقط در 8 كشور وجود داشته است كه کشورمان نیز نهمين كشور دارای این تکنولوژی است.
کاربرد آب سنگین
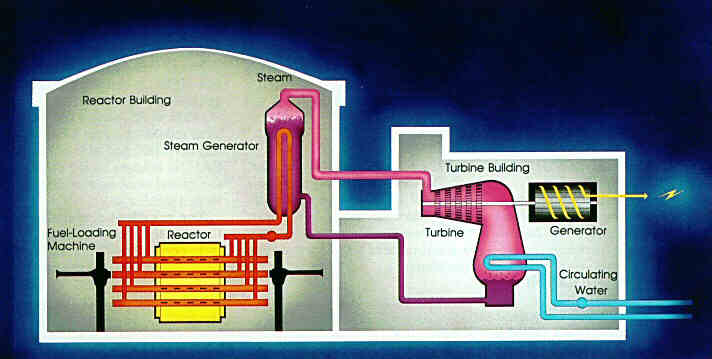
بيشترين استفاده از آب سنگين در رآكتورهای هستهای است، هم در رآکتورهای تحقيقاتي و هم در رآکتورهای نيروگاهي از آب سنگین استفاده میشود. این آب سنگین برای کند کردن نوترونها مورد استفاده قرار میگیرد. نيروگاههايي كه از انرژي شكافت اورانيوم استفاده مي كنند به 2 دستۀ نيروگاه آب سبك و آب سنگين تقسيم ميشوند. نيروگاه آب سبك داراي رآكتور آب سبك و نيروگاه آب سنگين داراي رآكتور آب سنگين هستند.
آب سنگین در برخي از رآكتورهای هستهای به عنوان كند كننده سرعت نوترون به كار میرود. نوترونهای كند میتوانند با اورانیوم واكنش بدهند. از آب سبك یا آب معمولی هم میتوان به عنوان كند كننده استفاده كرد، اما از آنجا كه آب سبك نوترونهای حرارتی را هم جذب میكند، دررآكتورهای آب
سبك باید اورانیوم غنی شده (اورانیوم با خلوص زیاد) را به كار برد، اما رآكتور آب سنگین میتواند از اورانیوم معمولی یا غنی نشده هم استفاده كند.
اگر چه آب سنگین را بيشتر به دليل كاربرد آن در نيروگاههاي هستهاي ميشناسند. اما اين ماده در پژوهشهای علمی در رشتههاي زیستشناسی، پزشكی، فیزیك، شيمي و مهندسي نیز كاربردهای فراوانی دارد. كه در ادامه به چند مورد از آن اشاره می شود:
- طیفسنجی تشدید مغناطیسی هسته: در طیفسنجی تشدید (Resonance) مغناطیسی هسته (NMR)، هنگامی كه هسته مورد نظرپژوهشگر، هیدروژن و حلال مورد نظر آب باشد، در این حالت سیگنالهای اتم هیدروژن مورد نظر با سیگنالهای اتم هیدروژن آب معمولی تداخل میكند، برای جلوگیری از این تداخل، میتوان به جای آب معمولی از آب سنگین بهره گرفت، زیرا ويژگيهاي مغناطیسی دوتریم و هیدروژن با هم تفاوت دارد و سیگنال دوتریم با سیگنال هیدروژن تداخل نمیكند.
- . آشكار سازی نوترینو: رصدخانه نوترینوی سادبری در انتاریوی كانادا از هزار تن آب سنگین استفاده میكند. این آشكارساز نوترینو درژرفاي زمین و در دل یك معدن قدیمی كار گذاشته شده تا نئونهای پرتوهای كیهانی به آن نرسد. هدف اصلی این رصدخانه یافتن پاسخ این پرسش است كه آیا نوترینوهای الكترون كه از همجوشی در خورشید تولید میشوند، در مسیر رسیدن به زمین به دیگر انواع نوترینوها تبدیل میشوند یا خیر. وجود آب سنگین در این آزمایشها ضروری است، زیرا دوتریم مورد نیاز برای آشكارسازی انواع نوترینوها را فراهم میكند.
- آزمونهای سوخت و ساز در بدن: از مخلوط آب سنگین با آبی كه اكسیژن آن ایزوتوپ O18 است و نهO16، برای انجام آزمایش اندازه گیری سرعت سوخت و ساز بدن انسان و جانوران بهره ميگيرند. این آزمون سوخت و ساز را «آزمون آب دوبار نشاندار» مینامند.
- تولید تریتیم: هنگامی كه دوتریُم رآكتور آب سنگین یك نوترون به دست میآورد به تریتیُم، ایزوتوپ دیگر هیدروژن تبدیل میشود. تولید تریتیم به این روش به فناوری چندان پیچیدهای نیاز ندارد و آسانتر از تولید تریتیُم به روش تبدیل نوترونی لیتیم ۶ است. تریتیم در ساخت نیروگاههای گرما-هستهای كاربرد دارد.