خُردمغذی های شبه فلزی و نافلزی
خُردمغذی های شبه فلزی و نافلزی (Semi-metallic and non-metallic micronutrients)
خُردمغذی های شبه فلزی و نافلزی : بور، سیلیکون و آرسنیک از متداول ترین شبه فلزات خُردمغذی و فلوئورید، ید و سلنیوم از متداول ترین نافلزات خُردمغذی در آب های طبیعی هستند. در این بخش، بور، سیلیکون و فلوئورید بحث می شوند.

بور
عنصرر بور (B) اولین عنصر در گروه سیزدهم جدول تناوبی، با عدد اتمی 5 و جرم مولی g/mol 10811 است. فراوانی بور در پوستۀ زمین به طور متوسط ppm 9 و در خاک بین 18 تا ppm 63 است. مهم ترین کانی بور، بوراکس است که در تولید شیشه های مقاوم به حرارت، شوینده ها، کودها و غیره استفاده می شود.
بور از طریق هوازدگی سنگ ها، آب شویی خاک، فعالیت های آتشفشانی و دیگر فرایندهای طبیعی و نیز از طریق فاضلاب های شهری و صنعتی و زه آب های کشاورزی وارد آب های طبیعی می شود. بوریک اسید (H3BO3) که در آب به کندی تجزیه می شود، گونه غالب بور در آب های شیرین است. غلظت بور در اکثر آب های سطحی از mg/L 0.1 تجاوز نمی کند و فقط در تعداد محدودی از منابع آب ممکن است به 1.5 تا mg/L 3 نیز برسد. در بعضی از چشمه های آب معدنی که قابلیت درمانی دارند، غلظت های بیشتر بور (حتی تا mg/L 48) نیز مشاهده شده است. متوسط غلظت بور در آب دریاها حدود mg/L 5 است.
گرچه بور یک عنصر ضروری برای رشد گیاهان است، لیکن غلظت زیاد آن در آب یا خاک برای گیاه مضر است و بدین دلیل، توصیه می شود که غلظت بور در آب کشاورزی از mg/L (برای گیاهان حساس) تا mg/L 6 (برای گیاهان مقاوم و آبیاری کوتاه مدت) تجاوز نکند. استاندارد آب آشامیدنی در ایران غلظت های مطلوب و مجاز بور را به ترتیب، صفر و mg/L مقرر کرده است.
چندین روش برای اندازه گیری بور در آب، از جمله روش های نورسنجی و پلاسمای جفت شده القایی، توسعه یافته اند.
سیلیکون و سیلیس
سیلیکون (Si)، دومین عنصر در گروه 14 جدول تناوبی، شبه فلز چهار ظرفیتی، با عدد اتمی 14 و جرم مولی g/mol 28.085 است. در طبیعت، به ندرت عنصر سیلیکون به صورت آزاد یافت می شود و معمولاً به صورت سیلیکون دیو کسید (معروف به سیلیس با فرمول شیمیایی SiO2) یا سیلیکات در کانی های مختلف وجود دارد. از نظر فراوانی، سیلیکون دومین عنصر (بعد از اکسیژن) در پوستۀ زمین است و 25.7 درصد وزن آن را شامل می شود. سیلیس، به عنوان فراوان ترین ماده در پوستۀ زمین، جزء اصلی کانی هایی همچون کوارتز، ماسه و سنگ ماسه است؛ به طوری که فراوانی آن از نظر جرمی در سنگ های مختلف از 7 تا 80 درصد و در خاک های مختلف از 50 تا 80 درصد متغیر است.
به دلیل فراوانی سیلیس در طبیعت، تقریباً تمام آب های سطحی و زیرزمینی دارای سیلیس محلول است که عمدتاً از هوازدگی کانی های سیلیسی یا فاضلاب های صنعتی منشأ می گیرد. ترکیب سیلیس دار به سه شکل محلول، نپمعلق و کلوئیدی در آب ها حضور دارند. ترکیبات سیلیس دار محلول در آب، شامل برخی سیلسیک اسیدهای ساده (مثل ارتوسیلسیک اسید) و گونه های تفکیک شده آنها و نیز ترکیبات آلی سیلیس دار هستند. واکنش انحلال سیلیس در آب و تشکیل ارتوسیلسیک اسید به صورت زیر است:
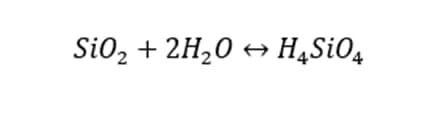
ارتوسیلسیک اسید در دو مرحله زیر تفکیک می شود:
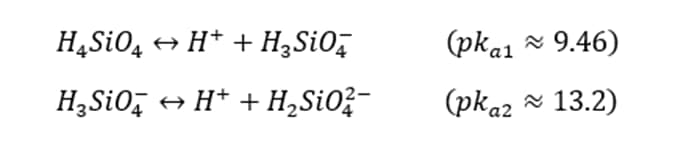
نسبت ارتوسیلسیک اسید به یون H3SiO4– برابر است با:
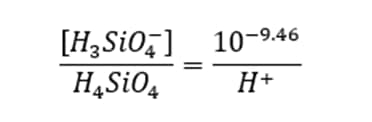
از رابطه بالا ملاحظه می شود که در pH کمتر از 9.46، گونه ارتوسیلسیک اسید نایونیده (H4SiO4) غالب است؛ بنابراین در اکثر آب های طبیعی، سیلیس محلول در آب، عمدتاً به شکل ارتوسیلسیک اسید نایونیده است.
غلظت سیلیس (بر حسب SiO2) در آ رودخانه ها و دریاچه ها معمولاً در گستره 1 تا mg/L 30 متغییر است، ولی مقادیر آن در آب های زیرزمینی بیشتر بوده و ممکن است به mg/L 1000 هم برسد. متوسط غلظت سیلیس در آب دریا mg/L 6.4 است.
سیلیس در حضور منیزیم، در دیگ ها و توربین های بخار، رسوب سفتی به جای می گذارد که برطرف کردن آم بسیار مشکل است؛ به طوری که در فصل رشد سلولی دیاتومه ها، سیلیس از آب حذف شده، و در فصل واپاشی لاشه های آنها در آب رها می شود؛ و بدین دلیل، گاهی تغییرات فصلی سیلیس در آب های سطحی و آب دریا مشاهده می شود.
در استانداردهای آب آشامیدنی، حداکثر مجاز برای سیلیکون یا سیلیس گزارش نشده است. غلظت سیلیس در آب را می توان با یکی از روش های رنگ سنجی، طیف سنجس جذب اتمی یا پلاسمای جفت شده القایی اندازه گیری کرد.
فلوئورید
فلوئوریدها به ترکیبات آلی یا معدنی حاوی عنصر فلوئور (F) گفته می شوند و در طبیعت در برخی از کانی ها، همچون فلوئوریت (کانی CaF2) و فلوئوراپاتیت [کانی Ca5(PO4)3F]، حضور دارند. فلوئوریدها حدود g/kg 0.3 از پوسته زمین را تشکیل می دهند. فلوئوریدها از طریق هوازدگی کانی های فلوئوردار و فاضلاب های صنعتی، وارد آب های طبیعی می شوند. در آب های طبیعی، فلوئوریدها عمدتاً به صورت آنیون فلوئورید (F–) و مقداری نیز به صورت هَمتافت حضور دارند.
غلظت فلوئورید در آب های طبیعی از 0.05 تا mg/L 100 متغیر است. غلظت فلوئورید در آب های با TDS<1000 mg/L معمولاً کمتر از mg/L 1 است؛ لیکن در آب های زیرزمینی، با غلظت بیش از mg/L 10 نیز مشاهده شده است. میانگین غلظت فلوئورید در آب دریاها mg/L 1.3 است. وجود فلوئورید در آب آشامیدنی، تا حدی مفید است که مانع از فساد (اصطلاح عامیانه کِرم خوردگی) دندان ها شود. در بعضی از نصفیه خانه های آب، به منظور کاهش فساد دندان، به آب حدود mg/L فلوئورید اضافه می شود که این عمل را فلوئورزنی می نامند. برای فلوئوردار کردن آب، معمولاً از ترکیبات هگزافلوئوروسیلسیک اسید، سدیم فلوئورید (NaF) و کلسیم فلوئورید (CaF2) استفاده می شود. تمام این ترکیبات در آب شکسته شده و یون فلوئورید آزاد می کنند. غلظت زیاد فلوئورید برای بدن انسان و حیوان سمی است؛ به طوری که استفاده طولانی مدت از آب با غلظت فلوئورید نسبتاً زیاد (>4 mg/L)، منجر به فلوئورسیس دندانی و با غلظت خیلی زیاد (15 تا mg/L 20)، منجر به بیماری فلوئورسیس استخوانی می شود. فلوئورسیس دندانی، آسیب دیدگی لعاب دندان ها توسط جذب فلوئورید زیاد در زمان شکل گرفتن لعاب دندان هاست. در نیتجۀ فلوئورسیس دندانی، ابتدا نقطه های سفید روی دندان ها ظاهر و سپس تبدیل به خال های قهوه ای دائمی می شوند؛ در چنین شرایطی، دندان ها زودتر از بین می روند. چون فلوئورسیس دندانی فقط در مدت تشکیل لعاب زخ می دهد، کودکان زیر ده سال به شدت مستعد این بیماری هستند.
استاندارد آب آشامیدنی ایران، سه غلظت (حداقل لازم، مقدار مناسب و حداکثر مجاز) را برای فلوئورید، به صورت تابعی از میانگین حداکثر دمای روزانه محیط، مشخص کرده است. برای مثال در شرایطی که میانگین حداکثر دمای روزانه میحط در محدودۀ 10 تا ℃ 12 باشد، غلظت های فلوئور mg/L 0.9 را برای حداکثر لازم، mg/L 1.2 را برای مقدار مناسب و mg/L 1.7 را برای حداکثر مجاز تعیین کرده است.
چندین روش برای اندازه گیری غلظت فلوئورید در آب، از جمله روش های الکترود یون گزین و تجزیۀ تزریقی جریانی، جریانی توسعه یافته اند.
منبع:
- تائبی، امیر (1398). کیفیت آب (مبانی و محاسبات)