عناصر کم مقدار و خُردمغذی ها (فلزات سنگین) در آب آشامیدنی
عناصر کم مقدار و خُردمغذی ها (فلزات سنگین) (
Trace elements and micronutrients (heavy metals)) در آب آشامیدنی
معمولاً در آب های طبیعی، بسیاری از عناصر با مقدار کم (عناصر کم مقدار و خُردمغذی ها(فلزات سنگین) )یافت می شود که از هوازدگی و انحلال سنگ ها و خاک ها، فاضلاب های شهری و صنعتی، زه آب های معادن و فعالیت های آتشفشانی مشأ می گیرند. نهشت جوّی نیز می تواند در افزایش غلظت بعضی از عناصر در آب های سطحی مؤثر باشد. برای مثال، هنوز در بعضی از کشورها، سرب به بنزین افزوده می شود که در چنین مناطقی سرب از اگزوز خودروها به جوّ انتشار می یابد و سپس وارد چرخۀ آب می شود. علت کم بودن غلظت عناصر کم مقدار در آب مربوط به حضور کم کانی های آنها در خاک و در ساختار زمین و نیز حل پذیری اندک یا حل ناپذیری آنها است.

طبق تعریف، عنصری که کمتر از 0/1 درصد پوسته زمین را تشکیل دهد، عنصر کم مقدار نامیده می شود. غلظت عناصر کم مقدار در آب های طبیعی معمولاً در محدودۀ میکروگرم بر لیتر (µg/L) تا نانوگرم بر لیتر (ng/L) یا قسمت در میلیارد (ppb) تا قسمت در تریلیون (ppt) قرار دارد. برای مثال، گسترۀ نوعی غلظت های زمینۀ عناصر کم مقدار در آب های طبیعی از 0/001 تا µg/L 0/1 است. بعضی از عناصر کم مقدار، جزء عناصر ضروریِ مورد نیازِ آبزیان هستند که اصطلاحاً خُردمغذی نامیده می شوند؛ به طوری که کمبود آنها باعث کاهش بهره وری زیستی منابع آب می شود. اگر غلظت های عناصر کم مقدار در آب های طبیعی، از طریق تخلیۀ فاضلاب های شهری و صنعتی یا عملیات معدن کاری، به بیش از حد نیاز آبزیان افزایش یابند، ممکن است برای اکوسیستم آبی و انسان سمی باشند و کاربری این آب ها را برای آبرسانی شهری و حتی مصارف صنعتی و آبیاری نامساعد گردانند.
آلودگی آب ها به فلزات سنگین، که ناشی از فعالیت های انسانی است، باعث مشکلات اکولوژیکی در بسیاری از مناطق دنیا شده است. اگر زی انباشت فلزات در آبزیان از حدّ مجاز تجاوز کند، خطر مسمومیت انسانی افزایش می یابد. در نتیجۀ جذب و ته نشینی در ستون آب، غلظت فلزات در ته رسوبات خیلی بیشتر از آب است. در ضمن، ته رسوبات دارای فلزات ممکن است با فرایندهای واجذب و انحلال نیز باعث آلودگی ثانویۀ آب شوند.
سمّیت فلزات در آب به درجۀ اکسایش و حالت حضور آنها بستگی دارد. برای مثال، درجه سمّیت کروم شش ظرفیتی (VI)Cr، بسیار بیشتر از کروم سه ظرفیتی (III)Cr است. به طور کلی، سمی ترین حالت فلز، گونه های یونی آن است. معمولاً از سمیت فلزات، وقتی درگیر در همتافت ها باشند، کاسته می شود. برای مثال، فلزات درگیر در مواد آلی طبیعی، همچون هیومیک اسید و فولویک اسید، از سمیت کمتری برخوردارند.
سازمان بهداشت جهانی (WHO) برای ارزیابی آلودگی آب ها به فلزات کم مقدار، پایش ده فلز و نیز دو شبه فلز (طبق جدول 1) را پیشنهاد کرده است. آژانس حفاظت محیط زیست آمریکا (USEPA)، در پایش منابع آب، هشت عنصر اولویت دار را طبق جدول 2 پیشنهاد کرده است. دیگر فلزات سنگین سمی، همچون Be، Tl، V، Sb و Mo نیز در صورت احتمال حضور در آب باید مورد ارزیابی قرار گیرند.
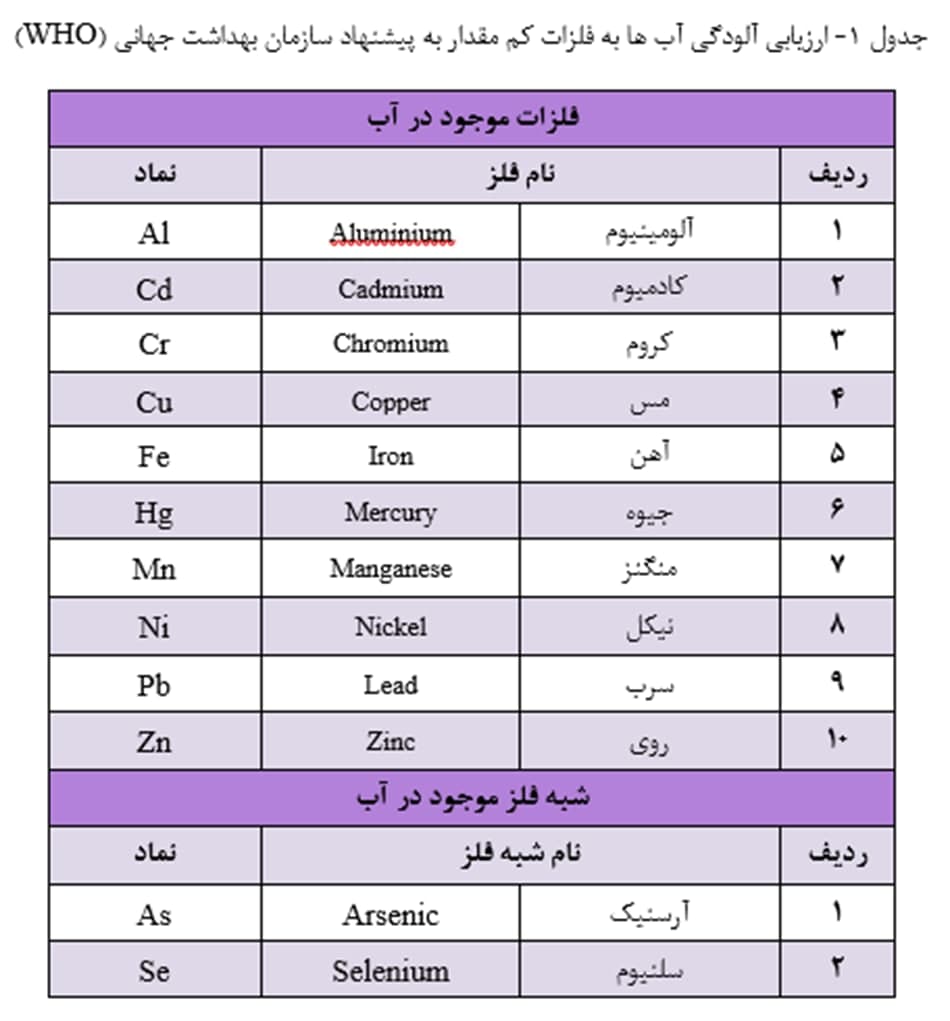
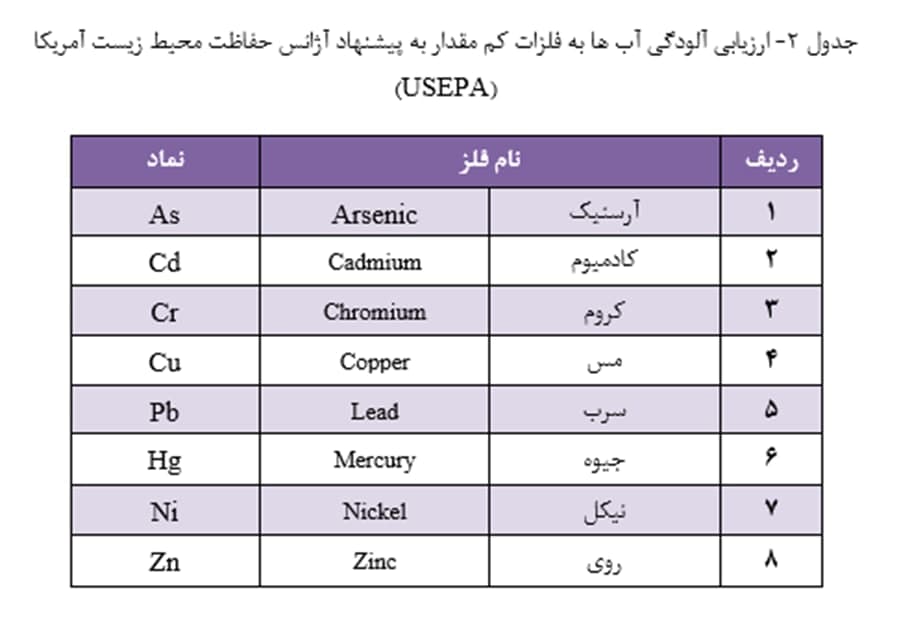
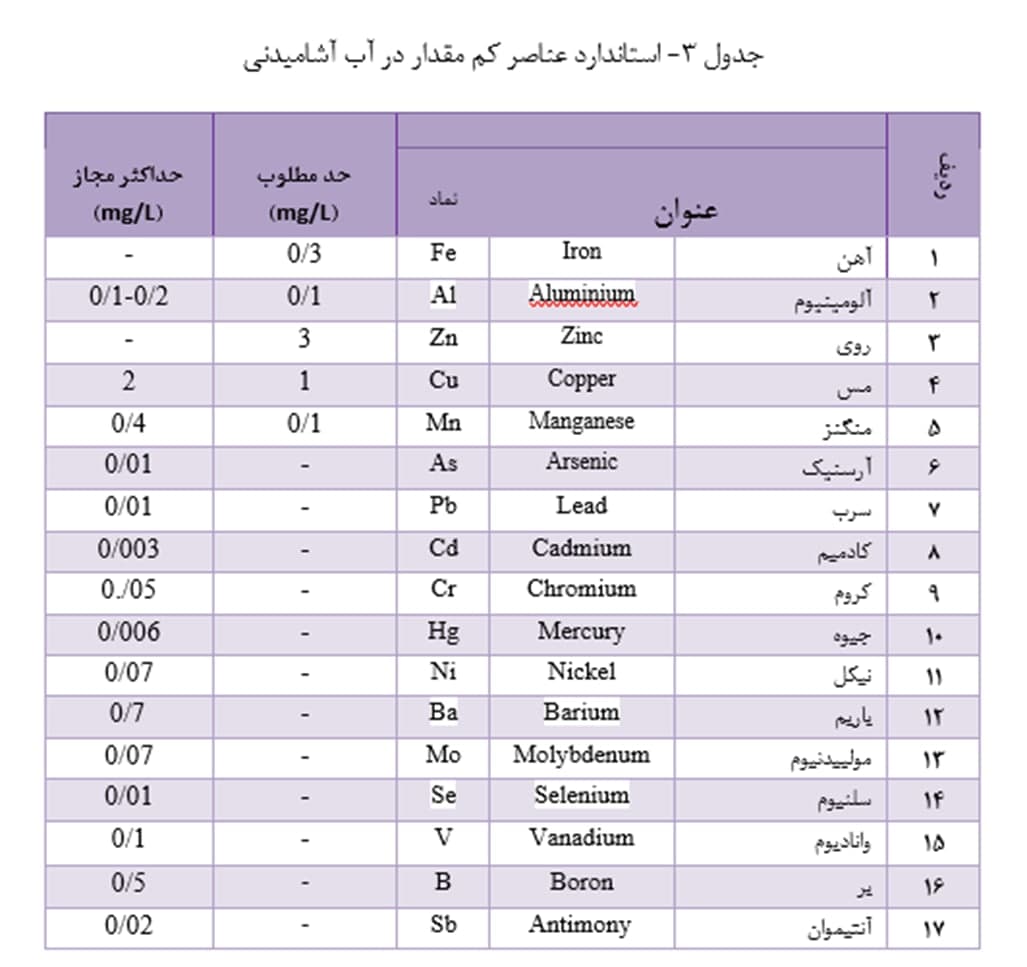
حداکثر غلظت مجاز عناصر کم مقدار در آب آشامیدنی باید در حدّی باشد که مسمومیت در انسان ایجاد نکند. در استانداردهای آب آشامیدنی، حداکثر غلظت مجاز برای فلزات، به خصوص برای فلزات سنگین، از حد چند میکروگرم بر لیتر (µg/L) تجاوز نمی کند (جدول 3).
عناصر کم مقدار در آب های طبیعی، بسته به مشخصات آب و نوع عنصر، می تواند به صورت های محلول، کلوئیدی و معلق حضور داشته باند. برای اندازه گیری غلظت فلزات محلول، باید نمونه را از صافی غشایی با قطر منافذ 45/0 میکرومتر عبور داد، سپس آن را در محل نمونه گیری، قبل از انتقال به آزمایشگاه، اسیدی کرد. اسیدی کردن نمونه ها برای جلوگیری از وقوع فرایندهای مؤثر بر غلظت عنصر، همچون جذب و آب کافت، انجام می گیرد. اندازه گیری عناصر کم مقدار در آب را به دلیل کم بودن غلظت، باید با روشهای تجزیۀ دستگاهی انجام داد. روش های نورسنجی، از قدیمی ترین و ارزان ترین روش های اندازه گیری غلظت فلزات هستند؛ ولی این روش ها را به دلیل محدودیت در غلظت آستانۀ تشخیص، فقط برای غلظت های نسبتاً زیاد موجود در آب های کاملاً آلوده می توان به کار برد. برای اندازه گیری غلظت فلزات در آب، روش های طیف نمایی جذب اتمی و پلاسمای جفت شدۀ القایی کاربرد وسیعی پیدا کرده اند. روش ولت-آمپرسنجی عریان سازی آندی نیز برای اندازه گیری غلظت بعضی از فلزات به کار می رود.
وقتی کانی فلزی در تماس با آب قرار گیرد، بین یون فلز حل شده و فاز جامد کانی تعادل برقرار می شود. اگر غلظت یون فلز حل شده، بیش از حد تعادل باشد، آن قدر رسوب رخ می دهد تا غلظت به حد تعادل برسد. برعکس، اگر غلظت یون فلز کمتر از حد تعادل باشد، کانی بیشتری در آب حل می شود تا غلظت به حد تعادل برسد. درضمن، یون آزاد فلز، با همتافت های فلز (زوج یون ها و همتافت های معدنی و آلی) در تعادل قرار می گیرد. از این رو، با تشکیل هَمتافت های فلز، غلظت فلز محلول (یعنی مجموع یون آزاد فلز و فلز مقید در هَمتافت های محلول) بیش از غلظت یون فلزِ در تعادل با فاز جامد است. بنابراین، با تشکیل هَمتافت های فلزی، میزان حل پذیری کانی فلز بیشتر می شود. البته باید توجه داشت که معمولاً تشکیل هَمتافت های فلز مربوط به یون های اصلی آب، همچون کلسیم، منیزیم، سدیم و پتاسیم، بر کیفیت آب تأثیر قابلِ ملاحظه ای ندارند؛ زیرا کل غلظت های هَمتافت های این فلزات در مقابل غلظت یون های آزاد آنها قابل توجه نیستند. برعکس، بخش قابلِ توجهی از هر عنصر کم مقدار می تواند با یون های اصلی با بار الکتریکی مخالف، زوح یون تشکیل دهد؛ به طوری که گاهی مقدار یون های درگیر در زوج یون های درگیر در زوج یون ها بیش از مقدار یون آزاد است.
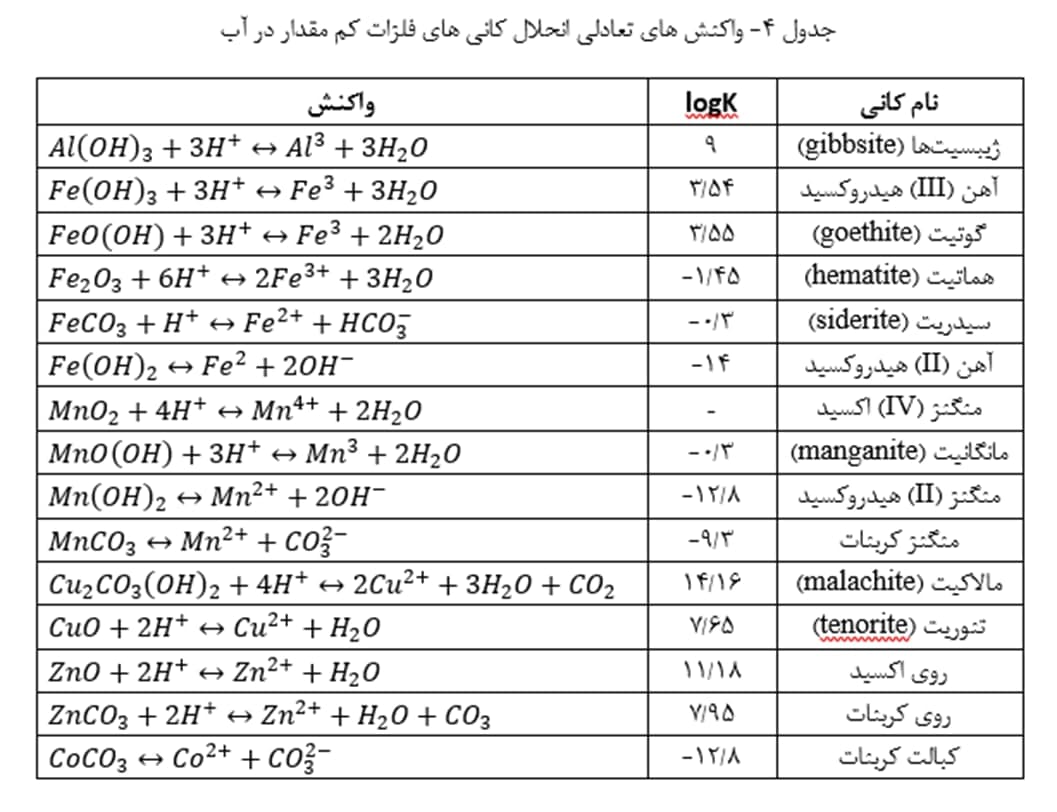
در جدول 4، واکنش های انحلال بعضی از کانی های فلزات کم مقدار در آب های اسیدی ارائه شده اند. pH آب، حل پذیری کانی ها را تغییر می دهد؛ به طوری که با کاهش pH، غلظت یون فلز آزاد افزایش می یابد.
خَردمغذی های فلزی
آهن، منگنز، روی، مس، کادمیوم، کبالت و مولیبدن از متداول ترین خُردمغی های فلزی در آب های طبیعی هستند که در زیر فقط به شرح آهن، منگنز، روی و مس پرداخته می شود.
آهن
آهن (Fe) اولین عنصر در گروه هشت جدول تناوبی، با عدد اتمی 26 و وزن مولکولی 55/85 است. آهن، حدود 6/22 درصد وزن پوستۀ زمین و 0/5 تا 4/3 درصد وزن خاک ها را شامل می شود. در طبیعت، آهن به ندرت به صورت آزاد یافت می شود و معمولاً در کانی هایی همچون هماتیت (کانی Fe2O3)، ماگنتیت (کانی Fe3O4)، پیریت (کانی FeS2) و تاکونیت حضور دارد. آهن به طور وسیع در تولید فولاد و دیگر آلیاژهای فلزی به مصرف می رسد. آهن یک عنصر ضروری برای موجودات زنده است و حداقل نیاز انسان به آن، بسته به جنسیت، سن، و وضعیت فیزیولوژیکی، 10 تا mg/L 50 است.
آهن در حالت فرو (Fe2+) در آب حل پذیر است و در حضور هوا یا با افزودن اُکسنده ها، اکسید شده و به فریک (Fe3+) نامحلول تبدیل می شود. چون آب های زیرزمینی، غالباً بی اکسیژن یا کم اکسیژن هستند، آهن در آنها به شکل فرو محلول است. در قسمت های عمیق دریاچه ها و مخازن که غلظت اکسیژن محلول آنها کم است، آهن به شکل فرو محلول حضور دارد. غلظت آهن محلول غیر هَمتافتی در آب های سطحی جاری، باحالت اشباع از هوا، معمولاً کمتر از آب های زیرزمینی است. متوسط غلظت آهن در رودخانه ها mg/L 0/7 و در آب های زیرزمینی بین 0/1 تا mg/L 10 است. متوسط غلظت آهن در آب دریاها mg/L 0/01 است. در آب های کم اکسیژن با pH بین 6 تا 8، غلظت آهن ممکن است به mg/L 50 برسد. چون آهن با مولکول های آلی، هَمتافت تشکیل می دهد، غلظت آن در آب های سطحی اسیدی یا آب های در تماس با مواد گیاخاکی ممکن است به mg/L 10 برسد.
بعضی از باکتری های شیمی خودپرورد هوازی، موسوم به باکتری های اکسنده آهن، قادرند آهن فرو را به عنوان الکترون دهنده مصرف کنند که در نتیجۀ آن، آهن فرو به آهن فریک اکسیده می شود. این باکتری ها معمولاً در چاه ها، تصفیه خانه ها و خطوط آبرسانی در شرایطی حضور دارند که اکسیژن وجود داشته باشد و غلظت آهن محلول نیز بیش از mg/L 0/2 باشد. بنابراین، باکتری های اکسندۀ آهن، بیشتر در نواحی نیم پایدار (بین شرایط بی هوازی و هوازی) حضور دارند. به طوری که در این نواحی، بین باکتری های اکسندۀ آهن و واکنش های اکسایش آهن، برای مصرف اکسیژن رقابت وجود دارد. در این فرایند، باکتری های اکسندۀ آهن، لعاب لایه ژلاتینی قهوه ای رنگ تولید می کنند که تجمع آن باعث زی جِرم گرفتگی توری چاه، لوله، شیر آب و زهکشی فاضلاب می شود. خیلی اوقات، باکتری های آهن در آب، بو و طعم نامطلوب تولید می کنند.
بعضی باکتری های شیمی دگرپرورد بی هوازی، موسوم به باکتری های کاهندۀ آهن، قادرند آهن فریک را به عنوان الکترون پذیر مصرف کنند که در نتیجۀ آن، آهن فریک به آهن فرو کاهیده می شود. در نتیجۀ چنین فعالیت باکتریایی، غلظت آهن فرو در ته رسوبات و آب های بی اکسیژن افزایش یافته و زیست خوردگی در دیوارۀ لوله ها و سطوح فلزی رخ می دهد.
آب حاوی غلظت زیاد آهن، علاوه بر فراهم شدن زمینۀ رشد باکتری های آهن و ایجاد مشکلات مربوطه، هنگام خارج شدن از شیر، بلافاصله آهن محلول آن اکسیده و آهن نامحلول فریک تشکیل می شود؛ در نتیجه، آب ابتدا کدر و سپس نارنجی رنگ می شود. درضمن، چنین آبی باعث به جای گذاردن لکه های قرمز – قهوه ای یا زرد رنگ روی تأسیسات بهداشتی، ظروف و لباس های شسته شده می شود. از دیگر مشکلات آهن در آب، ایجاد طعم زنندۀ نامطبوع با غلظت آستانۀ حدود mg/L 3/0 است. بنابراین باتوجه به آنکه آهن بک عنصر ضروری برای موجودات زنده است، حضور آن در غلظت های متداول در آب های طبیعی و آشامیدنی، اشکال بهداشتی ندارد؛ بلکه مشکلات آن مربوط به جنبه های زیبایی شناختی و گوارایی آب است. استاندارد آب آشامیدنی ایران حداکثر غلظت مطلوب آهن را mg/L 1/0 و حداکثر غلظت مجاز آن را mg/L 1 مقرر کرده است.
روش های استاندارد اندازه گیری غلظت آهن در آب عبارت اند از: روش های طیف نمایی جذب اتمی، روش پلاسمای جفت شدۀ القایی (ICP) و روش رنگ سنجی با فنانترولین.
منگنز
منگنز (Mn) اولین عنصر در گروه هفتم جدول تناوبی، با عدد اتمی 25 و وزن مولکولی 54/93 است. فراوانی منگنز در پوستۀ زمین به طور متوسط ppm 1060 و در خاک ها از 61 تا ppm 1010 است. در طبیعت، منگنز هم به صورت عنصر آزاد و هم در کانی های پیرولوزیت (کانی MnO2)، رد کرزیت (کانی MnCO3)، برونیت و پسی لوملان وجود دارد. منگنز در آلیاژهای فولاد، باطری ها و افزودنی های غذایی کاربرد دارد. منگنز یک عنصر ضروری برای اتمام موجودات زنده است.
شیمی و رفتار منگنز در آب، شبیه به آهن است. گونه های متداول منگنز در آب، منگنز کاهیده (Mn2+) و منگنز اکسیده (Mn4+) هستند. منگنز کاهیده، گونه غالب منگنز محلول در آب های زیرزمینی بی اکسیژن و قسمت های عمیق دریاچه ها و مخازن است که اگر در معرض هوا یا دیگر اُکسنده ها قرار گیرد، به Mn4+ نامحلول اُکسیده شده و رسوب می کند. غلظت های منگنز در آب های طبیعی، معمولاً حدود ده مرتبه کمتر از آهن است. میانگین غلظت در رودخانه ها mg/L 0/007 و در آب های زیرزمینی کمتر از mg/L 0/1 است. البته در مواردی مشاهده شده که در آب های زیرزمینی، در شرایط بی اکسیژنی و در تماس با کانی های منگنز، غلظت های منگنز برای آب های خنثی تا mg/L 1/3 و برای آب های اسیدی تا mg/L 9/6 افزایش یافته است. متوسط غلظت منگنز در آب دریاها mg/L 0/002 است.
منگنز در آب، همانند آهن، باعث مشکلات طعم، تغییر رنگ و لکه گذاری می شود. متوسط غلظت آستانۀ طعم برای منگنز mg/L 0/1 است. وقتی آب های زیرزمینی منگنزدار در معرض هوا قرار گیرد، منگنز آن اکسیده شده، رسوب سیاه منگنزدیوکسید (MnO2) تشکیل می شود که باعث لکه گذاری روی تأسیسات بهداشتی، ظروف آشپزی و لباس های شسته شده می شود. مشکل تغییر رنگ آب نیز وقتی مشاهده می شود که غلظت منگنز از mg/L 0.15 تجاوز کند. بنابراین حضور منگنز در غلظت های متداول در آب های طبیعی در آشامیدنی، اشکال بهداشتی ندارد، بلکه مشکلات آن مربوط به جنبه های زیبایی شناختی و گوارایی آب است. استاندارد آب آشامیدنی ایران برای منگنز حداکثر غلظت مطلوب را mg/L 0.05 و حداکثر غلظت مجاز را mg/L 0.5 مقرر کرده است.
روش های استاندارد اندازه گیری غلظت منگنز در آب عبارت اند از: روش های طیف نمایی جذب اتمی، روش پلاسمای جفت شدۀ القایی و روش رنگ سنجی با پرسولفات.
روی و مس
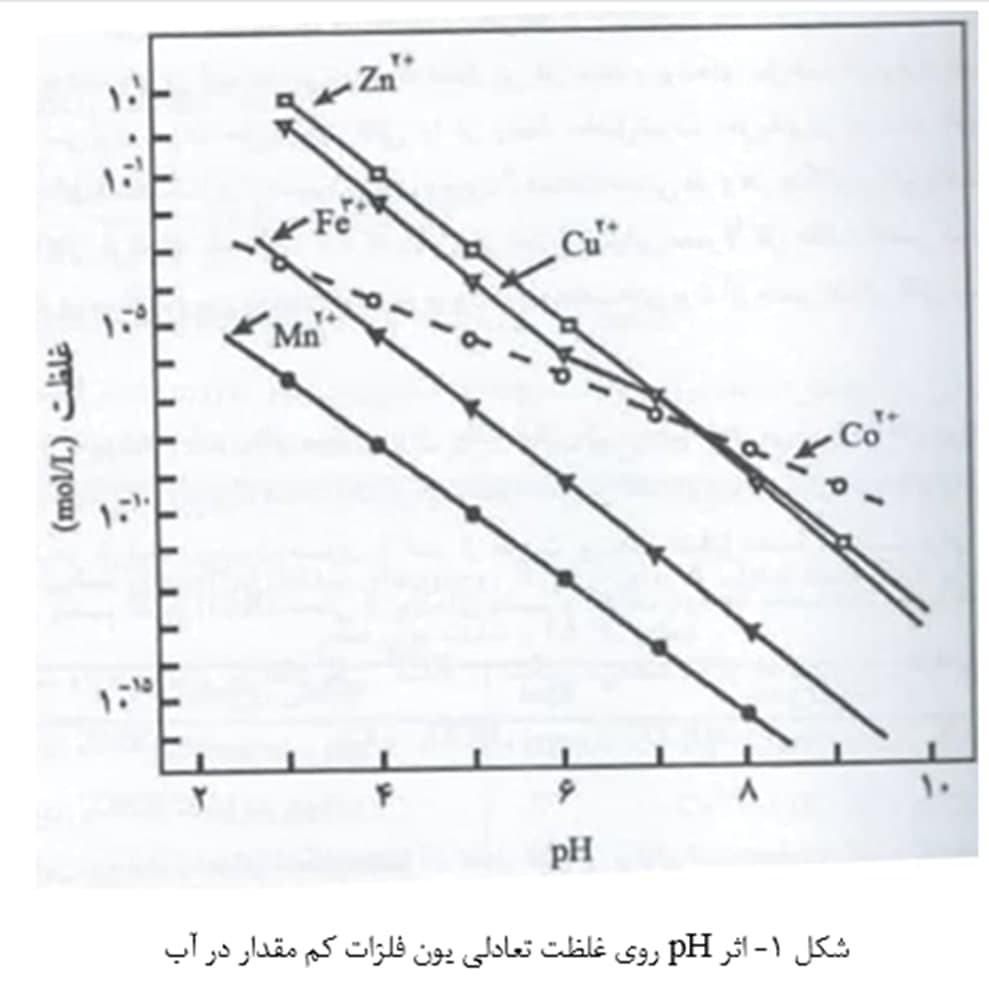
مس و روی از عناصر ضروری برای موجودات زنده هستند. در پوستۀ زمین، مس عمدتاً به صورت سولفیدها، اکسیدها و کربنات ها، و روی به صورت سیلیکات ها سولفیدها، اکسیدها و کربنات ها یافت می شوند. در pH اکثر آب های طبیعی، غلظت یون های مس و روی آزاد، به واسطۀ حل پذیری اندک کانی های آنها، کم است (شکل 1). اندازه گیری های 1500 نمونۀ آب سطحی در آمریکا نشان داد که متوسط و حداکثر غلظت مس محلول، به ترتیب، 0/015 و 0/28 میلی گرم بر لیتر و متوسط و حداکثر غلظت مس محلول، به ترتیب، 0/064 و 1/18 میلی گرم بر لیتر بودند. در آب های اقیانوسی، متوسط غلظت مس 0/003 میلی گرم بر لیتر و متوسط غلظت روی 0/01 میلی گرم بر لیتر است.
منبع:
- تائبی، امیر (1398). کیفیت آب (مبانی و محاسبات)










