فسفر در آب
فسفر در آب
فسفر (P)، یک عنصر نافلز چند ظرفیتی، جزء گروه 15 جدول تناوبی، با عدد اتمی 15 و جرم مولی g/mol 30/974 است. فسفر به دلیل واکنش پذیری شدید با هوا و نیز با بسیاری از مواد اکسیژن دار، در طبیعت به صورت آزاد یافت نمی شود؛ ولی در بسیاری از کانی ها، همچون آپاتیت، وجود دارد. فسفر ماده مغذی برای تمام جانداران است و همانند نیتروژن، معمولاً یکی از عوامل اصلی محدود کننده رشد گیادروایان و گیاهان آبزی در اکوسیستم های آبی است. بنابرین، افزایش سطح فسفر توسط فعالیت های انسانی در پیکره های آبی که فسفر عامل محدود کنندۀ رشد زیستی در آنهاست، موجب تحریک رشد موجودات آبزی فوتوسنتزی و نهایتاً وقوع پدیدۀ بیش پرورش در آنها می شود. به همین دلیل باید از ورود فسفر به منابع آب، از طریق فسفرزدایی فاضلاب ها در تصفیه خانه ها و مدیریت کیفیت رواناب های شهری و کشاورزی، جلوگیری شود.

منابع طبیعی فسفر در آب های طبیعی، عمدتاً هوازدگی سنگ های حاوی فسفر و تجزیه مواد آلی هستند. فسفر از طریق فاضلاب های شهری و صنعتی (به خصوص فاضلاب های حاوی شوینده ها) و زه آب های زمین های کشاورزی نیز وارد آب های سطحی می شود. فسفر ته رسوبات و لجن های پیکره های آبی، به صورت گونه های معدنی رسوبی، یا مقید در ترکیبات آلی، حضور دارد و ممکن است توسط فعالیت های باکتریایی مجدداً وارد ستون آب شود. گاهی ترکیبات فسفر، برای کنترل خورندگی، به آب درخطوط آبرسانی و سیستم های خنک کن افزوده می شود.
فسفر در آب های طبیعی و فاضلاب ها، تقریباً همیشه به شکل فسفات حضور دارد. فسفات ها به ارتوفسفات ها، فسفات های متراکم (مثل پیروفسفات، متافسفات و دیگر پلی فسفات ها) و فسفات های مقید در مواد آلی طبقه بندی می شوند. فسفات ها به صورت های محلول یا معلق و نیز در بدن آبزیان و ته رسوبات وجود دارند.
چون فسفر سریعاً توسط گیاهان جذب می شود، معمولاً غلظت آن در آب های شیرین بسیار کم است. در اکثر آب های سطحی طبیعی، محدوده غلظت فسفر بین 0/005 و mgP/L 0/02 است. گاهی غلظت های کمتر در برخی از آب های طبیعی بکر و غلظت های بیشتر در بعضی از آب های شور محصور (تا mgP/L 200( نیز مشاهده شده است. به دلیل مصرف ترکیبات فسفر در تولید شوینده ها، غلظت فسفر کل در فاضلاب های شهری ممکن است به 4 تا mgP/L 16 برسد. غلظت های زیاد فسفر در منابع آب، معمولاً نشانگر آلودگی آنها به فاضلاب ها و رواناب های زمین های کوددار است.
-
فسفریک اسیدها و فسفات ها
ساده ترین ترکیب از سوی فسفریک اسیدها، ارتوفسفریک اسید با فرمول شیمیای H3PO4 است که گاهی فسفریک اسید نیز نامیده می شود. ارتوفسفریک اسید، یک اسید سه پروتونی ضعیف است که در دما و فشار معمولی به شکل جامد (با نقطه ذوب حدود ℃ 42) است، و به دلیل داشتن موکلول قطبی، در آب بسیار حل پذیری است. حالت اکسایش فسفریک اسیدها 5+ است. سه مرحله تفکیک (یونش) ارتوفسفریک اسید در آب را می توان به طور خلاصه با واکنش های زیر نشان داد:

آنیون های تشکیل شده بعد از اولین، دومین و سومین مرحله تفکیک را به ترتیب، آنیون در هیدروژن فسفات (H2PO4–)، آنیون هیدروژن فسفات (HPO42-) و آنیون فسفات یا ارتوفسفات (PO43-) می نامند. فسفات، به نمک یا استر ارتوفسفریک اسید گفته می شود. استر فسفریک اسید را ارگانوفسفات نیز می نامند.
اثر pH بر توزیع گونه های H3PO4، H2PO4–، HPO42- و PO43- در شکل 1 نشان داده شده است. ملاحظه می شود که H3PO4 در آب های خیلی اسیدی و PO43- در آب های خیلی قلیایی گونه های غالب هستند. در محدوده pH اکثر آب های طبیعی، گونه های H2PO4– و HPO42- غالب اند؛ به طوری که در pH کمتر از 7/3 گونۀ H2PO4– و در pH بیشتر از 7/3 گونه HPO42- از درصد بیشتری برخوردارند.
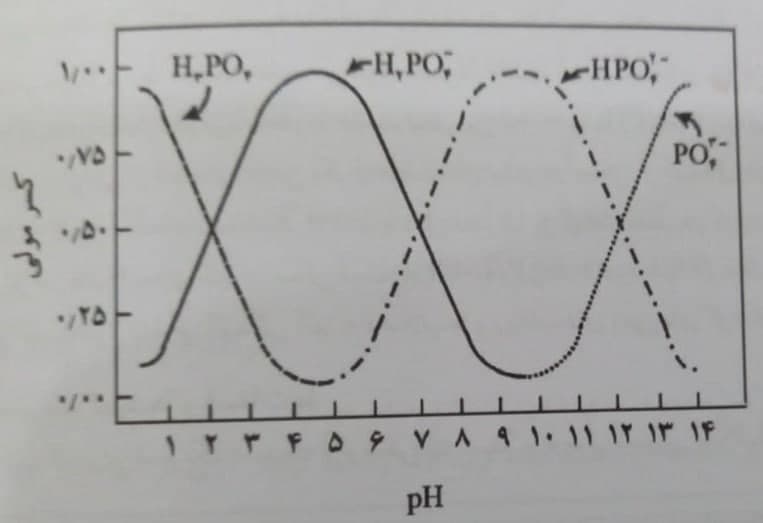
شکل 1- اثر pH بر توزیع گونه های مختلف ارتوفسفریک اسید آب
از تراکم دو مولکول ارتوفسفریک اسید و خذف یک مولکول آب آنها، پیروفسفریک اسید (H4P2O7) تشکیل می شود.

پیروفسفریک اسید، چهار مرحله تفکیک دارد، به طوری که در هر مرحله تفکیک، یک یون H+ از دست می دهد. پیروفسفات به نمک یا استر پیروفسفریک اسید گفته می شود. از تراکم سه مولکول ارتوفسفریک اسید، تری پلی فسفریک اسید (H5P3P10) و از تراکم چهار مولکول ارتوفسفریک اسید، تتراپلی فسریک اسید (H6P4P13) تشکیل می شود. فرمول کلی پلی فسفریک اسیدها ه صورت HO(PO2OH)xH است که در آن x تعداد واحدهای فسفریک در مولکول است. تری پلی فسفات به نمک یا استر تری پلی فسفریک اسید، تتراپلی فسفات فسفات به نمک یا استر تتراپلی فسفریک اسید و به طور کلی پلی فسفات به نمک یا استر پلی فسفریک اسید گفته می شود.
در تشکیل پلی فسفریک اسید، واحدهای فسفریک در یک ردیف به هم می پیوندند، متافسفریک اسید تشکیل می شود. فرمول کلی متافسفریک اسیدها به صورت (HPO3)x است که در آن x تعداد واحدهای فسفریک در مولکول است. در واقع در تولید متافسفریک اسیدها، دو مولکول آب از تراکم دو مولکول ارتوفسفریک اسید حذف می شود و با آب زدایی بیشتر، نهایتاً فسفریک انیدرید (P4O10) تشکیل می شود.
فسفریک اسیدها، به دلیل داشتن مولکول های قطبی، معمولاً در آب حل پذیرند. در آب، فسفات های آمونیوم و فلزات قلیایی به خوبی حل پذیرند؛ لیکن فسفات های فلزات قلیایی خاکی در حدّ متوسط حل می شوند و فسفات های دیگر فلزات، بسیار کم حل پذیرند. در محلولهای آبی، پلی فسفات ها به تدریج آب کافت شده و سرانجام به ارتوفسفات تبدیل می شوند.
در آب ها و ته رسوبات اسیدی، از واکنش بین گونه های فسفریک اسید با آهن و آلومینیم محلول در آب، فسفات های آهن و آلومینیم نامحلول تشکیل می شوند که با افزایش pH از حل پذیری آنها کاسته می شود؛ در نتیجۀ ته نشینی این فسفات ها، از غلظت های فسفر، آهن و آلومینیوم محلول در آب کاسته می شود. در ضمن مونوکلسیم فسفات [Ca(H2PO4)2] در آب به خوبی حل پذیر است و در تهیه کود کشاورزی کاربرد دارد. با افزایش pH آب، گونه های نامحلول کلسیم فسفات ها (مثل آپاتیت) تشکیل شده و از غلظت فسفر آب کاسته می شود.
-
اندازه گیری فسفر
اندازه گری فسفر در آب شامل دو مرحله است:
- تبدیل تما گونه های فسفر به ارتوفسفات محلول
- تعیین مقدار ارتوفسفات به روش رنگ سنجی.
در روش های مختلف اندازه گیری فسفر، گونه های فسفر محلول، فسفر معلق، فسفر معدنی (ارتوفسفات ها و فسفات های متراکم) و فسفر آلی از هم تفکیک می شوند.
برای تفکیک گونه های فسفر محلول و معلق، نمونه ها را از یک صافی غشایی با قطر منافذ 0/45 میکرومتر عبور می دهند. مقدار فسفر موجود در نمونه صاف شده، معرف فسفر محلول، و مقدار فسفر باقی مانده روی صافی، معرف فسفر معلق است.
برای اندازه گیری فسفات های متراکم، باید آنها را با فرایند آب کافت به ارتوفسفات تبدیل کرد و برای اندازه گیری فسفر آلی نیز باید آن را با هضم اکسایشی به ارتوفسفات تبدیل کرد.
در شیمی تجزیه، فسفات هایی که بتوان بدون آب کافت و هضم اکسایشی با روش رنگ سنجی اندازه گیری کرد، فسفر واکنشی می نامند. در آزمایش فسفر واکنشی، ارتوفسفات ها و بخش کوچکی از فسفات های متراکم اندازه گیری می شوند. فسفات های متراکمی که در این آزمایش اندازه گیری می شوند، آنهایی هستند که در حین آزمایش، به طور ناخواسته مورد آب کافت قرار می گیرند. فسفر واکنشی خود شامل دو قسمت محلول و معلق است.
برای اندازه گیری فسفات های متراکم، نمونه در دمای جوش و اسیدی، آب کافت می شود تا فسفات های متراکم محلول و معلق، به ارتوفسفات محلول تبدیل شوند. در فرایند آب کافت نیز فسفات های موجود در بعضی از ترکیبات آلی، به طور ناخواسته آزاد می شوند که این مشکل را می توان با کاهش زمان آب کافت و انتخاب اسید مناسب به حداقل رساند. معمولاً فسفر اندازه گیری شده پس از فرایند آب کافت را فسفر آب کافت شدنی اسیدی (به جای فسفات متراکم) می نامند. فسفر آب کافت شدنی اسیدی نیز شامل دو قسمت محلول و معلق است.
فسفات هایی را که پس از هضم اکسایشی نمونه اندازه گیری می کنند، فسفر آلی می نامند. فسفر آلی نیز همانند فسفر واکنشی و فسفر آب کافت شدنی اسیدی، شامل دو قسمت محلول و معلق است.
بنابراین، از نظر شیمی تجزیه، فسفر کل و بحش های محلول و معلق آن، هرکدام شامل سه بخش: فسفر واکنشی، فسفر آب کافت شدنی اسیدی و فسفر آلی هستند. بخش فسفر معلق را می توان از تفاضل فسفر کل و فسفر محلول برآورد کرد و یا آن را به طور مستقیم با هضم مواد باقی مانده روی صافی اندازه گیری کرد.
-
چرخۀ فسفر
در چرخۀ فسفر، گونه های معدنی و آلی فسفر، به طور طبیعی، به یکدیگر تبدیل می شوند. فسفر معدنی محلول توسط گیادروایان و گیاهان آبزی جذب شده و جزئی از زیست تودۀ آنها می شود (فرایند جذب گیاهی فسفر). فسفر آلی گیاهان، از طریق زنجیرۀ غذایی به حیوانات منتقل می شود و بخشی از آن وارد زیست تودۀ حیوانی و بخش دیگر با فضولات حیوانی دفع می شود. معمولاً گیاهان حاوی 0/05 تا 0/5 درصد و مهره داران، همچون ماهیان، حاوی 2 تا 3 درصد (بر مبنای وزن خشک) فسفر هستند. فسفر موجود در فضولات حیوانی و بقایای آبزیان، مورد تجزیۀ میکروبی قرار گرفته و به فسفر معدنی تبدیل می شود (فرایند کانی سازی فسفر آلی). در شکل 2، چرخه فسفر در اکوسیستم های آبی نشان داده شده است.
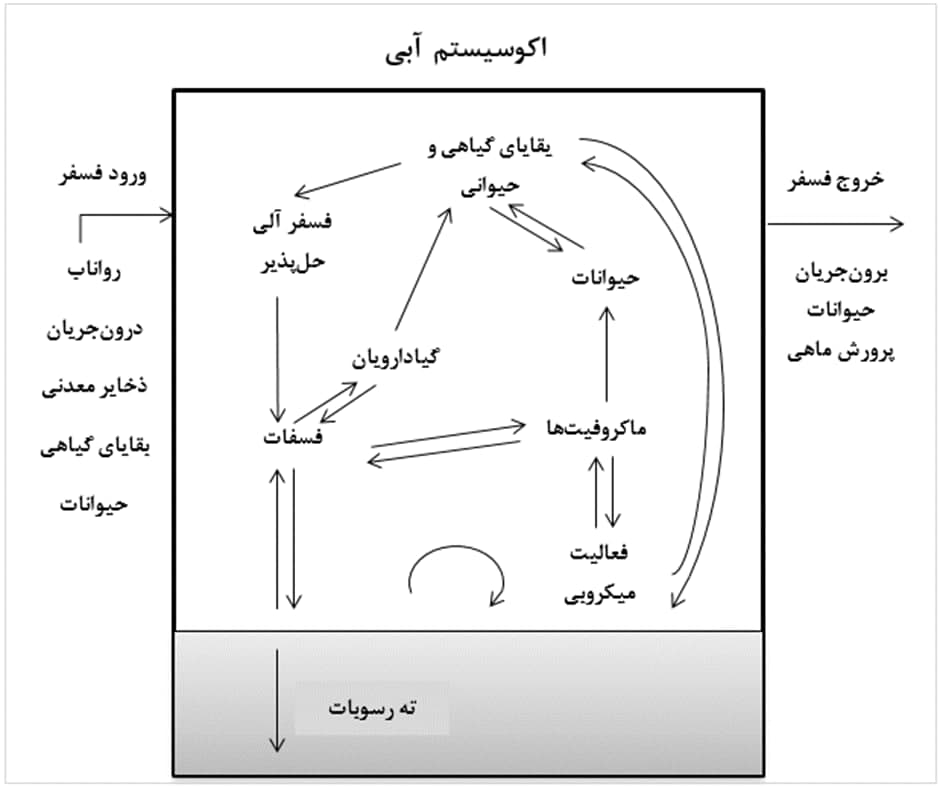
شکل 2- چرخه فسفر در اکوسیستم آبی










