اندازه گیری سختی آب
اندازه گیری سختی آب
اندازه گیری سختی آب به معنای تعیین غلظت یون کلسیم و منیزیم در نمونه آب می باشد. آنالیز سختی آب در دو مرحله انجام می شود. در مرحله اول سختی کل و در مرحله دوم سختی کلسیمی محاسبه می شود. در گذشته سختی آب توسط اندازهگیری ای که در مورد ظرفیت آب در رسوب کردن صابون انجام می شد،شناخته می شد. سختی آب همان ظرفیت آب در ترسیب صابون است. ظرفیت آب توسط یونهای دوظرفیتی مثبت بویژه +Mg2 و +Ca2 تعیین می شود.

سختی منیزیمی – سختی کلسیمی = سختی کل
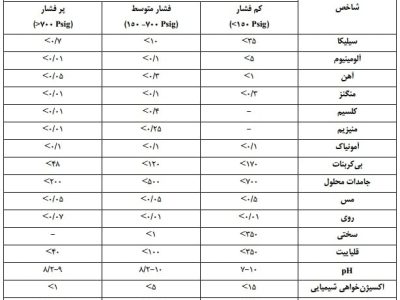
باید توجه داشت که فلزهای چند ظرفیتی دیگر اغلب در فرمهای کمپلکس با ترکیبات آبی میباشد اما نقش آنها ممکن است بسیار کم باشد. سختی آب ممکن است از صفر تا صدها میلیگرم بر لیتر کربنات کلسیم باشد که این امر وابسته است به منبع و حوضچهای که آب از آن انتخاب شده است. مقدار سختی آب علاوه بر اینکه در آبهای صنعتی اهمیت وافر دارد از نظر بهداشت عمومی نیز اهمیت دارد. کلسیم که یکی از عوامل سختی آب است در رشد استخوان و حفظ تعادل بدن دخالت دارد ولی به همان میزان سولفات کلسیم به علت کمی قابلیت هضم ناراحتیهایی در دستگاه هاضمه بوجود میآورد.
فیلم آموزشی روش اندازه گیری سختی آب
ضرر های سختی آب برای سلامت
- ایجاد سوهاضمه
- کدر مردن آب جوش
- کاهش گوارایی آب
- دیر پز شدن حبوبات و سبزیجات
- کف نکردن صابون
انواع سختی آب
- سختی موقت: این نوع سختی به دلیل ترکیب کلسیم و منیزیم با یون های هیدروکسید، کربنات، بیکربنات می باشد که به صورت محلول در آب وجود دارد.
- سختی دائم: این نوع سختی به دلیل حضور ترکیبات CaCO3،MgSO4،Mgcl2،Ca(NO3)2،Mg(NO3)2بوده که باعث خوردگی می شوند.
کربنات های کلسیم ومنیزیم در آب نامحلول می باشند. اما بیکربناتهای این یونها محلولاند.حضور کربن دی اکسید CO2 باعث می شود کربنات به بیکربنات تبدیل شود. حال اگر با جوشاندن یا ازیاد PH، CO2 را از آب خارج کنیم بیکربناتهای نامحلول رسوب کرده و از آب خارج می شود. به این دسته از مواد که با جوشاندن خارج میشود سختی موقت (سختی کربناته) می گویند، مابقی نمک های منیزیم و کلسیم باقیمانده در آب که با جوشاندن ازبین نمیروند را سختی دائم(سختی غیر کربناته) می گویند.
Mg (HCO3)2 → Mg(OH)2(S) + CO2(g
Ca (HCO3)2 → CaCO3 (g) + H2O + CO2 (g
آب را می توان از لحاظ سختی به گروه های گوناگون تقسیمبندی کرد: (ابعاد بر حسب میلیگرم بر لیتر caco3)
- آب نرم : 50>سختی کل
- نسبتا نرم : 100>سختی کل>50
- کمی سخت : 150>سختی کل >100
- نسبتا سخت : 250>سختی کل>150
- سخت : 350>سختی کل>250
- بسیار سخت : سختی کل>350
روشهای اندازهگیری سختی آب
دو روش برای اندازهگیری سختی ارائه شده است:
- در این روش سختی آب بوسیلهی حساب و برآورد برای اندازه گیری سختی همهی انواع آبها بکار میرود.در این روش سختی بوسیلهی محاسبه و رسم باردیاگرام گزارش میشود.
- روش تیتراسیون بوسیلهی محلول EDTA (دیسدیک اتیلن دیآمین تترا استیک استیک اسید)است.
روش 1) اندازه گیری سختی آب بوسیلهی محاسبه و برآورد
در این روش اندازهگیریها برای ترسیم منحنی است،جهت محاسبهی آن از نتایج مجزا و تعیین شده برای کلسیم و منیزیم استفاده میکنیم;بطور مثال:
H (mg/lit CaCO3) =1.947(mg/lit CaCO3) Ca + 3.818 (mg/lit CaCO3) Mg
روش 2) تیتراسیون:
به منظور اندازهگیری یون های منیزیم و کلسیم موجود در آب (همان سختی آب ) ابتدا با کمک هیدروکسید آمونیوم ، PH محیط را به 10 رسانده و سپس معرف اریوکریوم را به آن اضافه می کنیم. اگر هیچ یون فلزی ازکلسیم و منیزم در آب موجود نباشد این معرف در این شرایط به رنگ آبی است ولی کمپلکس های فلزی آن به رنگ قرمز شرابی یا نارنجی می باشد. پس اگر رنگ آن قرمز شود یون های فلزی در آن وجود دارد. اگر به چنین محلول قرمزرنگی محلول EDTA اضافه شود ابتدا با کلسیم سپس با منیزیم متصل به اریوکریوم کمپلکس تشکیل می دهد و ار آنجا که این کمپلکس ها،کمپلکس های با رنگ پایدار هستند اریوکریوم کاملا از قید یون های فلزی آزاد شده و آبی می شود. از آنجا که تشکیل کمپلکس کلسیم و منیزیم محیط را اسیدی میکند برای حفظ PH بین 10_9 که در آن معرف آبی رنگ است از هیدروکسید آمونیوم یا محلول بافر آمونیوم استفاده می شود.
مواد و وسایل مورد نیاز آزمایش سختی آب :
- محلول بافر
- محلول بازدارنده سدیم سولفید
- معرف اریوکریوم(EBT)
- محلول 0.1 مولار EDTA
- آب دوبار تقطیر شده
- دی اتیل آمین
- معرف کالکن
- ارلن
- پیپت حبابدار
- و….
روش کار آزمایش سختی آب
حجم نمونه را طوری انتخاب شود که این حجم کمتر از 15ml ،EDTA برای تیتراسیون نیاز داشته باشد. یک نمونه به حجم 25ml را با پیپت در ارلن ریخته و با آب دوبار تقطیر شده به حجم حدود 50ml میرسانیم، بهتر است که محلول را تا دمای 40 گرم کنیم. حدود 1-2 میلی لیتر محلول بافر اضافه می کنیم که معمولا 1 میلی لیتر کافی است که PH را در حدود 10 نگه دارد. 2ml محلول بازدارنده،حدود 3یا 2 قطره معرف اریوکریوم افزوده و فورا با محلول استاندارد EDTA که از قبل آماده کردیم در بورت میریزیم و تا ظهور رنگ آبی (این اتفاق در نقطه اکیوالانی محلول می افتد) تیتر می کنیم.
در هنگام تیتراسیون در نقطه پایانی رنگ محلول تغییر کرده و این بدان معناست که دیگر واکنشگر EDTA اضافه نکنیم و این یعنی رنگی که معرف در حالت قبل داشته(قرمز شرابی) از بین رفته و رنگ جدیدی(آبی) پیدا کرده است.
تعیین میزان کلسیم در حضور منیزیم :
مطابق آزمایش قبل 20ml آب را در ارلن رقیق میکنیم تا PH به حدود 5 برسد سپس 1ml محلول بازدارنده سدیم سولفید و 6 قطره معرف کالکن اضافه کرده و با محلول استاندارد EDTA تیتراسون را آغاز میکنیم تا ظهور رنگ آبی تیتراسیون را ادامه میدهیم.
نکات آزمایش سختی آب:
- اضافه کردن EDTA را با اختلاف 3 تا 5 ثانیه انجام دهید.
- توصیه میشود این کار در آزمایشگاه و در زیر نور سفید انجام شود که به تشخیص رنگ از قرمز به آبی کمک کند.
در مورد آبهای شیرین و آبهای طبیعی با سختی آب پایین (کمتر از 5mg/lit) حجم نمونه را از 100 تا 1000 میلی لیتر برای تیتراسیون افزایش میدهیم و به تناسب آن مقدار بیشتری از معرف و بافر لازم است،سپس تیترانت EDTA را از یک میکروبورت اضافه کرده و حین کار ظرف را تکان میدهیم.
محاسبات آزمایش سختی آب:
A × B × 105 mg/lit CaCO3 = سختی به روش EDTA
A ← میلیلیتر EDTAبرای تیتراسیون
B ← مولاریته EDTA










کاش در مورد کلر آب هم به مسوولین زیربط هشدار میدادین بابا این همه روش مدرن برای تصفیه آب هست اون کلر منفور لعنتی رو چرا میریزید داخل آب و آلودش میکنید. کاش هیچ ماده ی غیر طبیعی و شیمیایی و اضافی به آب طبیعی اضافه نمیشد.
بله متاسفانه کلر زنی از روش های قدیمی ولی رایج هستش…