اکسیژن محلول در آب
اکسیژن محلول در آب (DO):
آب در تماس با گازها میتواند مقادیر اندکی از آنها را در خود حل کند. هوا حاوی مقادیر زیادی نیتروژن و اکسیژن است که در آب حل میشوند. نیتروژن گازی است بیاثر و حضور آن اهمیت چندانی ندارد، اما اکسیژن محلول (DO) در آب میتواند سبب خوردگی شود. همچنین فرآیند فوتوسنتز گیاهان آبزی میتواند موجب تولید اکسیژن محلول در آب گردد. منظور از اکسیژن محلول فقط آن بخش از اکسیژن موجود در آب است که به صورت مولکولی حل شده است. میزان اکسیژن محلول در آبهای طبیعی و پساب به دما، فشار، فعالیتهای فیزیکی، شیمیایی، بیوشیمیایی و میزان نمکهای محلول در آب بستگی دارد. میزان اکسیژن محلول در آب اشباع سرد بیشتر از آبهای گرم میباشد. زیرا دمای بالای آب منجر به افزایش ارتعاشات مولکولی میشود، در نتیجه میزان فضای موجود بین مولکولهای آب کاهش یافته و حلالیت DO کم میشود. به دلیل تراکم کمتر O2 در فشار کم جوی و ارتفاع بالا، میزان DO در آب کاهش مییابد. همچنین میزان DO با افزایش نمکهای محلول در آب کاهش مییابد که به دلیل رقابت مؤثر یونهای نمک برای قرار گرفتن در فضاهای بین مولکولی آب است.
اکسیژن محلول در گوارایی و خوشطعم نمودن آب اهمیت زیادی دارد. زندگی حیوانات و گیاهان آبزی به کمینه غلظت اکسیژن محلول در آب بستگی دارد. مقدار اکسیژن محلول در آبی که ماهی در آن پرورش مییابد، نباید کمتر از 5 ppm باشد. در صورتی که اکسیژن موجود در آب کمتر از کمینه مجاز برای زندگی جانداران آبزی باشد، آن آب، آلوده تلقی میشود. اکسیژن محلول در آب یکی از دلایل اصلی خاصیت خورندگی آب میباشد و با توجه به مشکلات متعددی که وجود اکسیژن در آبهای صنعتی بهویژه در آب جوشآورها ایجاد میکند، حذف آن از این آبها ضروری است. از طرفی دیگر، با توجه به خاصیت اکسیدکنندگی محلول، حضور آن در کاهش میزان مواد آلی موجود در آب مؤثر است. از این رو آنالیز DO یک آزمایش مهم در بررسی آلودگی آب و کنترل فرآیند تصفیه پساب میباشد.
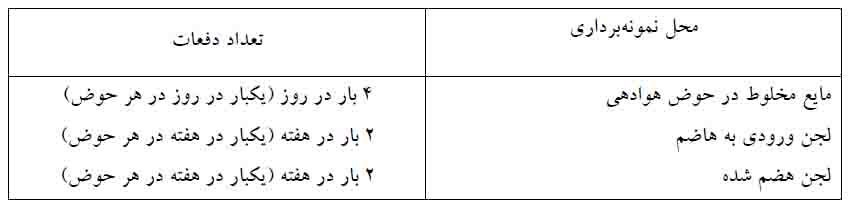
غلظت اکسیژن محلول در حوض هوادهی و حوض هاضم هوازی لجن در تصفیه خانهها، باید در محدوده معینی قرار داشته باشند. با استفاده از غلظت اکسیژن محلول لجن هضم شده، میتوان نرخ اکسیژن گیری ویژه 2 را به دست آورد . برای اطمینان از این مورد، باید مقدار غلظت اکسیژن محلول را دست کم یکبار در روز در مایع مخلوط هر حوض هوادهی و یکبار در هفته در حوضهای هوازی هاضم لجن اندازهگیری کرد. محل اندازهگیری و تعداد دفعات آزمایش تعیین غلظت اکسیژن محلول در این تصفیه خانه به شرح زیر است :
حلالیت (DO):
1. درجه حرارت
2. فشار جزئی اکسیژن در تماس با آب
3. شوری آب
عوامل کنترل کننده (DO):
1. مقدار مخلوط شدن اکسیژن بین هوا و آب
2. اکسیژن مورد نیاز بیوشیمیایی
3. اکسیژن مورد نیاز شیمیایی
اندازهگیری(DO):
ميزان اکسیژن محلول (DO) در آب و فاضلاب بستگي به فعاليتهاي بيوشيميايي، شيميايي و فيزيكي محيط آبي دارد. آزمايش ( Do ) يك آزمايش تعيين كننده و مهم در بررسي آلودگي آبها و كنترل فرايندهای زیستی، تصفيه آب و فاضلاب میباشد.
روشهای اندازهگیری اکسیژن محلول
سه روش برای تعیین مقدار DO در آب وجود دارد که عبارتند از:
روش یدومتری یک روش تیتراسیون است که براساس خاصیت اکسیدکنندگی DO عمل میکند. روش الکترود غشایی مبتنی بر سرعت نفوذ اکسیژن مولکولی در غشاء است. روش پراب نوری از حسگرهای اکسیژن مبتنی بر لومینساس[4] استفاده میکند. انتخاب روش به عوامل مداخلهکننده موجود، دقت مورد نیاز و در بعضی موارد راحتی روش بستگی دارد.
1- روش یدومتری
در این روش، محلول منگنز (II) سولفات (MNSO4) و پتاسیم یدید قلیایی (KI+NaOH) به نمونه که در یک بطری شیشهای درپوشدار است، اضافه میشود. در این واکنش، منگنز هیدروکسید (Mn(OH)2) تولید شده را به منگنز دی اکسید (MnO2) اکسید میکند. منگنز دیاکسید در حضور یونهای یدید در محلول اسیدی به حالت دوظرفیتی (mn2+) کاهش مییابد. در نتیجه مقداری ید (I2) معادل با مقدار DO اولیه در نمونه آزاد میشود. سپس ید با یک محلول استاندارد سدیم تیوسولفات (Na2s2O3) تیتر میشود. نقطه پاران تیتراسیون میتواند به صورت چشمی با شناساگر نشاسته یا به صورت الکترونیکی با تکنیکهای پتانسیومتری آشکار شود. واکنشهای انجامشده در این فرآیند به ترتیب زیر میباشند:

با توجه به واکنش ذکر شده، نقطه پایان واکنش با محو شدن رنگ آبی حاصل از اتصال ید-نشاسته مشخص میگردد. پس از پایان تیتراسیون با توجه به حجم مصرفی تیترانت میتوان مقدار DO نمونه را بر حسب ppm O2 از رابطه زیر محاسبه کرد:

اگر از آب مقطر به عنوان شاهد استفاده میشود، حجم مصرف شده تیترانت برای شاهد (Vtitrant For Blank) و نمونه مجهول (Vtitrant) را ثبت نمایید. حجم به دست آمده برای شاهد را از حجم بهدست آمده برای نمونه کم نموده (Vtitrant –Vtitrant For Blank) و در محاسبات قرار دهید.
تداخلها: برخی از اکسیدکنندهها سبب آزاد شدن ید میشوند که موجب خطای مثبت میگردد. برخی از مواد کاهنده نیز باعث کاهش ید به یدید میشوند که خطای منفی ایجاد میکند. همچنین، وقتی اسید به منگنز دیاکسید اضافه میشود، بیشتر مواد آلی تا حدی اکسید میشوند، در نتیجه خطاهای منفی ایجاد میکنند. اصلاحات زیر در روش یدومتری برای به حداقل رساندن تأثیر مداخلهکنندهها طراحی شده است:
الف- اصلاح آزید[5]: از اصلاح آزید بیشتر برای نمونههای فاظلاب، پساب و جویبارها استفاده میشود. این روش با استفاده از معرف یدید – آزید قلیایی (مخلوط NaI، NaN3 و NaOH به طور مؤثری تداخل نیتریت را که شایعترین تداخل در پساب تصفیه شده بیولوژیکی و اکسیژن خواهی بیوشیمیایی[6] (BOD) است، حذف میکند. برای استفاده از این روش سایر مواد کاهنده یا اکسیدکننده نباید وجود داشته باشند.
ب- اصلاح پرمنگنات[7]: از اصلاح پرمنگنات فقط در نمونههای حاوی آهن (II) استفاده میشود (به عنوان مثال، آب اسیدی). در این روش مخلوطی از محلول اسید سولفوریک غلظ، پتاسیم فلوئورید (KF) و مقدار کافی پتاسیم پرمنگنات (KMnO4) به نمونه مورد آزمایش اضافه شده به طوری که رنگ بنفش ایجاد شده در نمونه به مدت 5 دقیقه پایدار بماند. سپس به منظور حذف رنگ بنفش از مقدار مناسب پتاسیم اگزالات استفاده میشود. تداخل حاصل از غلظتهای بالای آهن (III) (تا چند صد میلیگرم در لیتر) ممکن است با اضافه کردن 1 میلیلیتر KF و یدید – آزید قلیایی در صورتی که تیتراسیون نهایی بلافاصله پس از اسیدی شدن انجام گیرد، برطرف شود. این روش برای اکسایش سولفیت، تیوسولفات، پلی تیونات یا مواد آلی موجود در فاضلاب بیاثر است.
ج- اصلاح لختهگذاری آلوم[8]: این روش، دخالت مواد جامد معلق را که ممکن است مقادیر قابل توجهی از ید در محلول اسیدی را مصرف کنند به کمترین مقدار میرساند. مواد جامد معلق موجود در نمونه توسط اضافه کردن مخلوطی از محلول آلوم (AlK(SO4)2) و آمونیوم هیدروکسید غلیظ (NH4OH) تهنشینی میشوند. سپس محلول شفاف رویی به منظور انجام تیتراسیون جدا میگردد.
د- اصلاح لختهگذاری مس سولفات – اسید سولفامیک: این روش برای تودههای بیولوژیکی (به عنوان مثال مخلوطهای لجن فعال) که میزان مصرف اکسیژن بالایی دارند، مورد استفاده قرار میگیرد. در این روش، به نمونه مورد آزمایش در یک ظرف درپوشدار محلول مس سولفات- اسید سولفامیک اضافه کرده تا مواد جامد تهنشین شوند. این محلول شامل مخلوطی از محلول مس سولفات (Cuso4)، اسید سولفامیک (NH2SO3H) و اسید استیک است. در ادامه محلول نسبتاً شفاف رویی را میتوان با هر روش اصلاح مناسب دیگر برای حذف سایر تداخلها تصفیه نمود.
اگرچه پژوهشگران اصلاحات مختلفی را در روش یدومتری برای از بین بردن یا به حداقل رساندن تداخلات خاص انجام دادهاند، این روش هنوز برای پسابهای مختلف صنعتی و خانگی قابل استفاده نیست. علاوه بر این، روش یدومتری برای آزمایش میدانی، نظارت مستمر یا تعیین DO در محل مناسب نمیباشد.
2- روش الکترود غشایی:
روشهای پاراگرافی با استفاده از الکترودهای قطره جیوه یا پلاتین چرخان برای تعیین مقدار DO در پساب خانگی صنعتی مناسب نمیباشند. زیرا ناخالصیهای موجود در محلول آزمایش، میتواند باعث مسمومیت الکترود یا سایر تداخلها شوند. این مشکلات هنگام استفاده از سیستمهای الکترود با پوشش غشاء به کمترین مقدار میرسند. زیرا حسگرها توسط یک غشای پلیمری تراوا نسبت به اکسیژن محافظت شده و مانع ورود ناخالصیها به حسگر میگردد. در شرایط پایدار، جریان به طور مستقیم متناسب ب غلظت DO است. الکترودهای غشایی گالوانیکی یا پلاروگرافی حساس به اکسیژن از دو الکترود فلزی جامد در تماس با الکترولیت پتاسیم کلرید جدا شده از محلول آزمایش توسط یک غشای انتخابی، تشکیل شدهاند. بخشی از الکترود غشایی مورد استفاده در اندازهگیری DO در شکل زیر (شکل 1) آورده شده است.

شکل 1- الکترود غشایی برای اندازهگیری اکسیژن محلول
از الکترودهای غشایی گالوارنیکی و پلاروگرافی برای اندازهگیری DO در دریاچهها و مخازن، برای بررسی جریان و کنترل صنعتی پساب، نظارت مداوم DO در واحدهای لجن فعال و مطالعات مربوط به رودخانههای بزرگ و اقیانوسشناسی استفاده میشود. الکرتودهای غشایی کاملاً فرو رفته زیر آب، برای آنالیز درجا مناسب هستند. قابلیت حمل، سهولت کار و نگهداری از ویژگیهای بارز این دستگاه میباشد. در تحقیقات آزمایشگاهی، از الکترودهای غشایی برای آنلیز مداوم DO در کشت باکتریایی، از جمله آزمایش BOD استفاده میشود. الکترود غشایی یک روش عالی برای آنالیز DO در آبهای آلوده، آبهای بسیار رنگی و فاضلابها ارائه میدهد. این روش بهطور خاص هنگامی توصیه میشود که برای روش یدومتری نامساعد بوده یا اینکه آزمایش در معرض خطای جدی مداخله کنندهها باشد.
تفاوت اساسی بین سیستمهای گالوانیکی و پلاروگرافی در این است که در حالت اول، واکنش الکترودها به صورت خودبخود است، در حالی که در سیستم پلاروگرافی به یک منبع خارجی برای اعمال ولتاژ نیاز است.
به طور معمول برای ساخت غشاء از پلیاتیلن و فلوروکربن استفاده میشود. زیرا در برابر اکسیژن مولکولی قابل نفوذ هستند. الکترودهای غشایی از نظر تجاری در انواع مختلفی در دسترس هستند. در تمام این ابزارها “جریان نفوذ” به صورت خطی متناسب با غلظت اکسیژن مولکولی است. جریان اندازهگیری شده، با استفاده از برخی روشهای کالیبراسیون به راحتی میتواند به واحدهای غلظت (به عنوان مثال میلیگرم در لیتر) تبدیل شود. از آنجا که الکترودهای غشایی آنالیز درجا را ارائه میدهند، خطاهای ناشی از حمل و نقل و ذخیرهسازی نمونه از بین میروند.
تداخلها: فیلمهای پلیمری مورد استفاده در سیستم الکترود غشایی به غیر از اکسیژن نسبت به گازهای مختلف قابل نفوذ هستند، اگرچه در الکترود اندازهگیری هیچکدام بهراحتی دپلاریزه نمیشوند. استفاده طولانی مدت از الکترودهای غشایی در آبهای حاوی هیدروژن سولفید (H2S) باعث حساسیت پیل میشود. این تداخل با تغییر مکرر الکترولیت، غشاء و کالیبرهکردن الکترود غشایی از بین میرود. رسوب گرفتگی غشاء مشکل دیگری است که به دلیل رشد باکتریها یا جلبکها، تجمع صابون، کف، پلیمر، چربی و مایعات آلی ایجاد میشود.
3- روش پراب نوری
پراب نوری از حسگرهای اکسیژن مبتنی بر لومینساس برای اندازهگیری ویژگیهای نشر نور از یک واکنش لومینسانس میکند. شکل 2 بخشی از پراب نوری برای اندازهگیری اکسیژن محلول را نشان میدهد.
شکل 2- بخشی از پراب نوری برای اندازهگیری اکسیژن محلول
اکسیژن به طور کمّی لومینسانس را خاموش میکند. تغییر در طول عمر سیگنال لومینسانس با غلظت DO مرتبط است. اندازهگیریهای مبتنی بر طول عمر از نوارهای آب و قرمز تنظیمشدهای که از دو منبع دیود[9] (LED) ساطع میشوند، استفاده میکنند. نور آبی به ماده لومینسانس موجود در کلاهک حسگر پراب برخورد میکند که در هنگام برانگیختگی نور قرمز را آزاد میکند. اکسیژن این نور قرمز را دفع میکند و باعث تغییر فاز در سیگنال برگشتی میشود که توسط یک فوتودیود شناسایی میشود. هرچه غلظت اکسیژن بیشتر باشد، نور قرمز سریعتر دفع شده و کندتر توسط دیود شناسایی میشود. پراب مدت زیادی طول میکشد تا مواد لومینسانس به حالت پایه برگردند را اندازهگیری میکند. در بین فلشهای نور آبی، یک LED جداگانه نور قرمز را بر روی کلاهک حسگر پراب منتشر میکند و از این طریق به عنوان یک استاندارد داخلی عمل میکند. پراب با مقایسه اندازهگیری طول عمر انتشار نورهای آبی و قرمز، غلظت DO را محاسبه میکند. این روش برای آبهای حاوی mg/L (0/05 تا 20) اکسیژن محلول کاربرد دارد.
تداخلها: دیاکسید کلر میتواند در این واکنش تداخل ایجاد کند. رسوب گرفتگی باکتریایی به دلیل وجود باکتریها با رشد جلبکها از نفوذ اکسیژن جلوگیری نمینماید. باکتریها و جلبکها همچنین میتوانند اکسیژن را تولید یا مصرف کنند و موجب خطا در اندازهگیری شوند. همچنین روغنها میتوانند غشاء و کلاهک حسگر را مسدود کرده و از انتشار و رسیدن اکسیژن به حسگر جلوگیری کنند. شستشوی مکرر بین اندازهگیریها میتواند این مشکلات را کمترین میزان برساند. الکلهای مختلف و حلالهای آلی نیز میتوانند به طور دائمی به پراب آسیب بزنند.
تمامی این آزمایشات و سایر آزمایشهای مربوط به آب و فاضلاب مانند کاتیونها و آنیونهای آب در آزمایشگاه آب و فاضلاب آبرام تست میشود.
[1] winkler
[2] Membrane-electrode method
[3] Optical-probe method
[4] luminescence
[5] azide modification
[6] Biochemical oxygen demand
[7] Permanganate modification
[8] copper sulfate-sulfamic acid flocculation modification
[9] diode
منبع:
اسدآبادی، سیمین و همکاران (1399). کنترل کیفیت آب – مبانی و روشها.










