ایجاد تعادل شیمیایی در آب
ایجاد تعادل شیمیایی در آب
ایجاد تعادل شیمیایی در آب آشامیدنی توزیع شده در شبکه آب شهری که پس از خروج از تصفیه خانه های آب مورد استفاده قرار می گیرد با اهمیت است. آب خالص هرچند که دارای ناخالصی است، قابلیت هدایت الکتریکی خیلی کمی دارد که به دلیل وجود یون های مثبت و منفی در آن است. آب خالص به مقدار کمی یونیزه می شود. آب خالص به تعداد مساوی یون های OH− و H+ تولید می کند.
میزان این یون ها مساوی و برابر 0.00000007 یون گرم بر لیتر است.
0H– + H+ <=> H2O
به علت کمی یون های مقادیر یون های حاصل شده مقدار آب تفکیک نشده را می توان همیشه ثابت دانست و قانون تاثیر غلظت ها را در مورد واکنش بالا به شکل زیر نوشت.
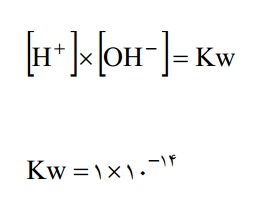
در تمام محلول های آۤبی با هر درجه اسیدی یا قلیایی رابطه بالا صادق است. با اندازه گیری و تعیین یک یون ، یون دیگر با استفاده از رابطه فوق بدست می آید. غلظت یون های فوق در آب را با اندازه گیری پی اچ تعیین می کنند که در واقع عکس لگاریتم غلظت یونی H+ است.

در رابطه بالا H+ بر حسب مول بر لیتر است.
در این صورت پی اچ این نمونه آب برابر است با ۷ که برای جلوگیری از نوشتن اعداد خیلی بزرگ به صورت لگاریتمی بیان می گردد. که پی اچ آب برابر است ۷ . هرگاه مقادیر PH و POH در آب یکسان باشند ، آب حالت خنثی دارد و هرچه مقدار عددی پی اچ از ۷ کمتر باشد ، غلظت یون هیدروزن از 0.00000007 بیشتر و محیط اسیدی تر است. در صورتی که پی اچ از ۷ بیشتر باشد، آب خاصیت قلیایی به خود می گیرد.
اندازه گیری و تعیین پی اچ بسیار مهم است و استفاده از آن در تفسیر نتایج آزمایش های شیمیایی و فیزیکی آب تاثیر گذار است.
پی اچ آب های زیرزمینیو سطحی بسته به نوع ناخالصی که در آنها وجود دارد معمولا ۷ نیست. مثلا چنانچه در نمونه آب، گاز کربنیک ، اسید آلی یا سولفات حل شده باشد،رقم پی اچ کاهش می یابد. و برعکس انحلال کربنات ها ، بیکربنات ها و هیدرکسید موجب افرایش رقم پی اچ می شود.










