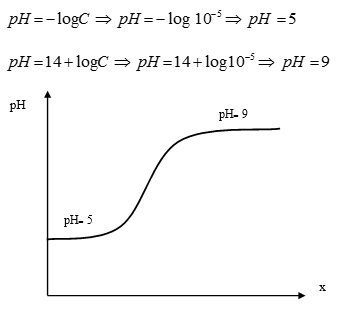تیتراسیون اسید قوی با باز قوی
تیتراسیون اسید قوی با باز قوی
در تیتراسیون اسید قوی با باز قوی که منحنی تیتراسیون اسید و باز قوی آن به شکل زیر می باشد ، نمك حاصل هيدروليز نخواهد شد و pH خاتمه عمل 7 خواهد بود. براي مثال، مي توان واكنش بين HCl و NaOH را در نظر گرفت. روابط به کار رفته برای رسم منحنی تیتراسیون اسید قوی بر اساس روش کار تیتراسیون با باز قوی به صورت زیر است. محصول واكنش شامل نمك و آب است. كلرايد سديم يك الكتروليت قوي است كه هيدروليز نميشود. اما H2O الكتروليت ضعيف ميباشد و بنابراين pH محلول در لحظه خنثي شدن بستگي به يونيزاسيون آب دارد. -H2O = H+ + OH در لحظه خنثي شدن، غلظت يونهاي H+ و OH– با يكديگر برابرند، بنابراين، با توجه به رابطه زیر در مي يابيم كه، pH محلول در لحظه خنثي شدن برابر 7 خواهد شد:
H+][OH–] = KH2O = 10 -14
روابط به کار رفته برای رسم منحنی تیتراسیون اسید قوی با باز قوی به صورت زیر است :
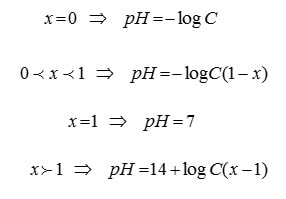
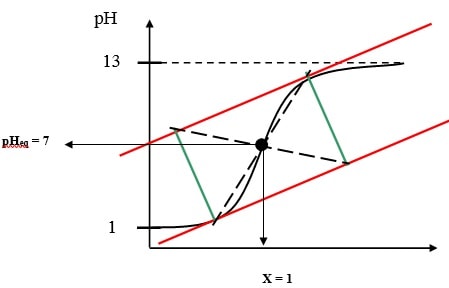
درباره تیتراسیون اسید قوی با باز قوی یا برعکس ، pH نقطه هم ارزی یا تعادل برابر 7 است. با این حال در کار تجربی پس از رسم منحنی تیتراسیون (به صورت pH بر حسب حجم سود معلوماعیار افزوده شده) به روش ترسیمی نقطه تعادل به دست میآید. روش کار بدین ترتیب است که در قسمت قوس شروع جهش و نیز پایان آن دوخط مماس بر انحناء و موازی با هم رسم میشود. (در شکل خطوط قرمز)، در ادامه دو خط به موازات هم و در نقاط تماس عمود بر نقطه مماس رسم میشود. (خطوط سبز) بدین ترتیب یک مستطیل حاصل میشود. حال قطرهای مستطیل رسم میگردد. محل تلاقی قطرها نقطه تعادل است.
به عنوان مثال حداقل غلظت لازم برای اسید هیدروکلریک در آلکالیمتری (اسیدیمتری) آن در حضور شناساگری با دامنه تغییر رنگ pHV 0.1± متفاوت از pH تعادل و خطای 1%± باید بدین ترتیب عمل کنیم که یکبار غلظت برای پیش از تعادل و یکبار دیگر برای پس از تعادل محاسبه شود.(مقدار خطا تابعی از غلظت و pH ویراژ میباشد)
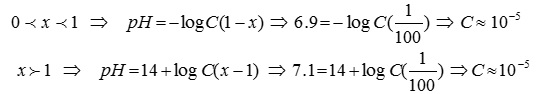
در عمل میتوان اسیدهای قوی با غلظت حداقل 0.00001M را اندازه گیری نمود، چراکه حداکثر خطا و حداقل تغییر دامنه شناساگر انتخاب شده است. در کل با توجه به منحنی تیتراسیون کمترین خطای تیتراسیون هنگامی است که جهش در منحنی به اندازه 4 واحد pH باشد. اگر در روابط مربوط به محاسبه pH به ترتیب زیر عمل نماییم خواهیم داشت: