روش اندازه گیری آهن کل
- روش اندازه گیری آهن کل
- نورسنجی با استفاده از معرف ارتوفنانترولین 1
- مزاحمت ها و نحوه حذف آنها:
- مواد و محلول های مورد نیاز:
- محلول استاندارد آهن:
- محلول هیدروکسیل آمین:
- آمونیاک
- محلول کلریدریک اسید 1+1:
- محلول کلریدریک اسید – نیتریک اسید:
- محلول 0.1 درصد ارتوفنانترولین:
- روش آزمایش
- نحوه انجام واکنش و ذکر نکاتی پیرامون آزمایش
- در رابطه با تشکیل کمپلکس فوق به نام Ferroin ذکر موارد زیر ضروری می باشد:
- اندازه گیری آهن 2 و 3 ظرفیتی و همچنین آهن کل به روش تیتراسیون و تشکیل کمپلکس با EDTA:
- مواد و محلول های مورد نیاز:
- EDTA (نمک دو سدیم آن):
- محلول سولفوسالیسیلات اسید درصد:
- کلریدریکاسید 1+1
- آمونیوم استات درصد:
- آمونیوم پرسولفات (NH4)2S2O8
- روش آزمایش
- بررسی معرف های مورد استفاده در آزمایش های اندازه گیری آهن و سختی (روش کمپلکس فلزی) و رنگ سنجی
- EDTA یا اتیلن دی آمین تترااستیک اسید (یا نمک دی سدیم آن)
روش اندازه گیری آهن کل
-
نورسنجی با استفاده از معرف ارتوفنانترولین 1
در این روش یون های دو ظرفیتی با ارتوفنانترولین واکنش می دهند و تلید ترکیبی به رنگ صورتی می نمایند که شدت رنگ ایجاد شده بستگی به غلظت آهن دو ظرفیتی در نمونه مورد آزمایش دارد. چنانچه در نمونه یون های سه ظرفیتی آهن نیز وجود داشته باشند به وسیله هیدروکسیل آمین احیا می شوند و به آهن دو ظرفیتی تبدیل می گردند.
مزاحمت ها و نحوه حذف آنها:
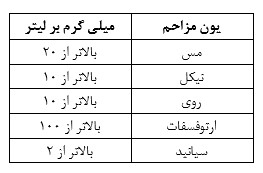
مقدار عناصری که می توانند در آزمایش مزاحمت ایجاد نمایند مطابق جدول زیر می باشند.
مواد و محلول های مورد نیاز:
-
آب مقطر بدون یون آهن، جهت تهیه محلول ها
-
محلول استاندارد آهن:
0.7032 گرم از نمک آهن (FeSO4,(NH4)2SO4, 6H2O) در 200 میلی لیتر محلول 5 درصد حجمی اسید کلریدریک بدون آهن حل کنید و حجم آن را به یک لیتر برسانید. از این محلول با رقیق کردن های مورد نظر جهت تهیه محلول های بعدی و رسم منحنی استاندارد استفاده نمایید.
-
محلول هیدروکسیل آمین:
10 گرم از هیدروکسیل آمین هیدروکلراید (NH2 – OH.HCL) را در 100 میلی لیتر آب مقطر حل کنید و در ظرف تیره نگهداری نمایید.
-
آمونیاک
-
محلول کلریدریک اسید 1+1:
حجم مشخصی از اسید را بردارید و با آب به همان حجم رقیق نمایید.
-
محلول کلریدریک اسید – نیتریک اسید:
حجم مساوی از کلریدریک اسید 1+1 و نیتریک اسید 1+1 را با هم مخلوط نمایید.
-
محلول 0.1 درصد ارتوفنانترولین:
0.1 گرم از ارتوفنانترولین را در 100 میلی لیتر آب حل کنید (چند قطره کلریدریک اسید غلیظ به آن اضافه نمایید) و در ظرف تیره و درب بسته نگهداری نمایید.
تذکر: محلولی که جهت رسم منحنی تهیه می شود باید همیشه تازه باشد.
روش آزمایش
حجم معینی از نمونه را (بستگی به میزان آهن دارد غلظت کمتر، نمونه بیشتر) در یک ظرف مدرج دهانه گشاد بریزید و 5 میلی لیتر کلریدریک اسید به آن اضافه کنید و سپس روی حمام یا جای مناسب دیگر (حمام شنی) حرارت دهید تا به حجم 5-10 میلی لیتر برسد، نمونه غلیظ شده را در یک بالن ژوژه 50 میلی لیتری بریزید و مجدداً ظرف را با کمی آب بشویید به آن اضافه نمایید. یک میلی لیتر هیدروکسیل آمین و 2.5 میلی لیتر محلول از توفنانترولین به محلول مواد آزمایش همراه با هم زده اضافه کنید. پس از این مرحله محلول را با (نمونه مورد آزمایش) قطره قطره آمونیاک در حضور کاغذ کنگورد خنثی نمایید تا تغییر رنگ کاغذ از آبی به قرمز pH=4، با پایان عمل خنثی سازی بالن ژوژه را با آب به حجم برسانید و روی طول موج 510 نانومتر مقدار جذب را اندازه گیری نمایید.
جهت حذف جذب آب و معرف های مورد استفاده، نمونه شاهدی شامل کلیه مراحل افزایش بالا بدون عمل جوشاندن با استفاده از آب مقطر فاقد آهن تهیه نمایید.
غلظت آهن بر حسب میکروگرم یا میلی گرم بر لیتر از روی منحنی تهیه شده به دست می آید.
نحوه انجام واکنش و ذکر نکاتی پیرامون آزمایش
همان گونه که مشاهده می شود واکنش تشکیل کمپلکس از طریق ایجاد پیوند کووالانس بین اتم های نیتروژن و آهن 2 ظرفیتی انجام می گیرد، ضمن این که سه مولکول ارتوفنانترولین با هریون آهن واکنش می دهند.
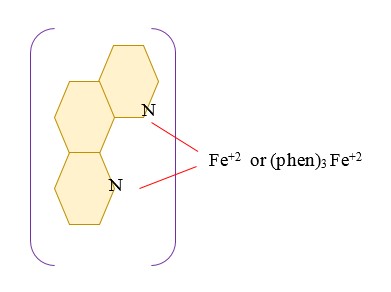
در رابطه با تشکیل کمپلکس فوق به نام Ferroin ذکر موارد زیر ضروری می باشد:
- واکنش مقابل در pH بین 3 و 9 تشکیل می گردد. چنان چه pH محیط کمتر از 3 باشد ارتوفنانترولین پروتونه می شود و بار مثبت ایجاد شده مانع از واکنش با آهن می گردد. هم چنین در pH بالاتر از 9 یون های فرو به صورت فروهیدروکسید رسوب می کنند و کمپلکس تشکیل نمی گردد. بهترین pH جهت انجام واکنش pH=4.5 می باشد.
- کمپلکس فوق که Ferroin نامیده می شود در بالاتر از ℃60 تجزیه می گردد.
- در صورت تغییر رنگ معرف های مورد استفاده آن ها را دور بریزید و مجدداً تهیه نمایید.
- چنان چه کلریدریک اسید قادر به انحلال و یونیزه کردن آهن نباشد می توانید از مخلوط کلریدریک اسید و نیتریک اسید استفاده نمایید.
- جهت بالا بردن دقت و حساسیت آزمایش باید از سل هایی با طول 5cm یا بیشتر استفاده کنید.
اندازه گیری آهن 2 و 3 ظرفیتی و همچنین آهن کل به روش تیتراسیون و تشکیل کمپلکس با EDTA:
در این روش آهن با استفاده از تشکیل دو کمپلکس با پایداری مختلف به صورت ساده اندازه گیری می شود.
اساس کار به این صورت می باشد که در صورت وجود یون های آهن سه ظرفیتی در محلول بعد از افزایش سولفوسالیسیلیک اسید محلول رنگ آلبالویی فروسولفوسالیسیلات به خود می گیرد و در موقع تیتر نمودن نمونه با EDTA فروسولفوسالیسیلات جای خود را با کمپلکس پایدارتری از آهن و EDTA که رنگ زرد لیمویی دارد می دهد. (شدت رنگ در هر دو کمپلکس بستگی به غلظت یون آهن دارد).
مواد و محلول های مورد نیاز:
-
EDTA (نمک دو سدیم آن):
این نمک را به مدت 5 ساعت در ℃80 خشک کنید 33.51 گرم آن را در آب بدون یون بریزید و رقیق نمایید و حجم آن را به یک لیتر برسانید.
-
محلول سولفوسالیسیلات اسید درصد:
(C7H6O6S,2H2O)100g اسید را در آب حل کنید و به حجم یک لیتر برسانید.
-
کلریدریکاسید 1+1
-
آمونیوم استات درصد:
200 گرم آمونیوم استات CH3COONH4 را در آب حل کنید و به حجم یک لیتر برسانید.
-
آمونیوم پرسولفات (NH4)2S2O8
روش آزمایش
5 میلی لیتر (یا بیشتر) نمونه را بردارید و به آن 100 میلی لیتر آب اضافه نمایید. توسط اسید کلریدریک یا آمونیوم استات pH را روی 0.5±2 تنظیم نمایید، سپس 5 میلی لیتر محلول سولفوسالیسیلات اسید اضافه کنید و با محلول EDTA0.9M تیتر نمایید تا زمانی که رنگ آلبالویی زرد کم رنگ یا بی رنگ گردد (مقدار مصرفی پس از محاسبه میزان آهن سه ظرفیتی را نشان می دهد) در پایان مرحله فوق به نمونه یک گرم آمونیم پرسولفات اضافه کنید و تیتراسیون را ادامه دهید تا رنگ آلبالویی به زرد یا زرد کم رنگ تغییر نماید. مقدار مصرفی B پس از محاسبه میزان آهن دو ظرفیتی را نشان می دهد. با استفاده از فرمول مقادیر B و A محاسبه می شود.

V= حجم نمونه
F= فاکتور تصحیح EDTA
A,B= مصرفی EDTA جهت آهن 3 و 2 ظرفیتی
بررسی معرف های مورد استفاده در آزمایش های اندازه گیری آهن و سختی (روش کمپلکس فلزی) و رنگ سنجی
اریوم کرم بلاک T:
اکثر شناساگرهای یون فلزی با پروتون نیز تشکیل پیوند می دهند و گونه هایی را ایجاد می کنند که رنگ آن ها با رنگ کمپلکس های فلزی ایجاد شده مشابه می باشند. بنابراین در صورتی که می توانید از این شناساگر برای یون های فلزی استفاده نمایید که رقابت یون فلزی با پروتون کم باشد و این امر در محدوده pH بالا میسر می باشد.
کمپلکس های فلزی اریوکرم بلاک T اکثرا قرمز می باشند. بنابراین برای مشاهده تغییر رنگ با این شناساگر، لازم است که pH در 7 یا بالاتر تنظیم گردد تا رنگ آبی شناساگر HIn2- در محیط ایجاد گردد. در این صورت نقلیه پایانی واکنش چنین خواهد بود.
باید توجه داشت که کمپلکس هایی از اریوکرم بلات T برای تعیین نقطه پایانی مناسب می باشند که ثابت تشکیل کمپلکس فلز شناساگر کمتر از یک دهم ثابت تشکیل کمپلکس فلز تیتر کننده باشند، در غیر این صورت، نقطه پایانی زودرس خواهید داشت. از طرف دیگر اگر این نسبت خیلی کوچک باشد، نقطه پایانی دیررس خواهید داشت. لازم به ذکر است که محلول های اریوکرم بلاک T در اثر ماندن به تدریج تجزیه می شوند.
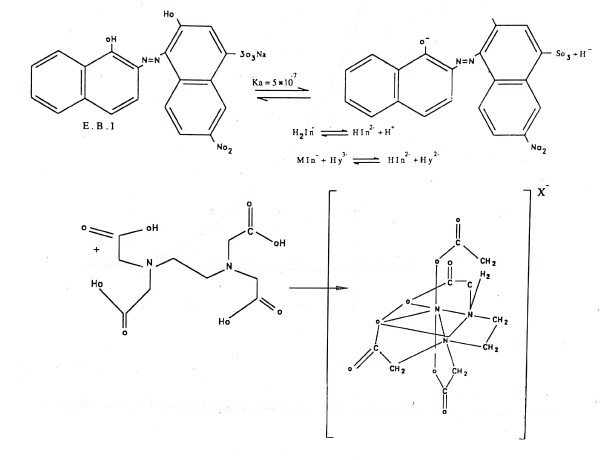
EDTA یا اتیلن دی آمین تترااستیک اسید (یا نمک دی سدیم آن)
اتیلن دی آمین تترااستیک اسید دارای ساختمان مولکولی زیر می باشد:

این ترکیب اسیدی است ضعیف که در آن PK1=2، PK2=2.67، PK3=6/16، PK4=10/26 می باشند. این کمیت ها، نشان می دهند که دو پروتون اول خیلی آسان تر از دو پروتون دیگر رها می شوند، علاوه بر این چهار هیدروژن اسیدی، هر اتم نیتروژن دارای یک زوج الکترون غیر مشترک است. بنابراین می توان EDTA را یک لیگاند شش دندانه ای در نظر گرفت جهتسهل تر شدن کار علامت های اختصاری H4Y، H3Y2- و HY3- و Y4- جهت EDTA و یون های آن به کار برده می شود.
همان گونه که در آزمایش ها متوجه شده اید، pH در هر آزمایش ثابت نمی باشد. بنابراین باید انتظار داشته باشید که گونه های مختلف از EDTA در محلول ها موجود باشد. شکل a پنچ گونه محتوی EDTA که می تواند در یک محلول آبی وجود داشته باشد را نشان می دهد. شکل نشان می دهد که در یک pH معین فراوان ترین گونه چه می باشد. مثلاً H2Y2- فراوان ترین گونه در محیط اسیدی ملایم است (pH 3 الی 6) و در pH=6-10، HY3- جزء عمده است.

از خاصیت مهم و با ارزش EDTA به عنوان تیتر کننده آن است که با یون های فلزی صرفنظر از بار کاتیون به نسبت 1+1 ترکیب می شود. در محلول اسیدی و محیط های قلیایی، می توان واکنش ها را به صورت زیر فرمول بندی کرد.

در محیط خنثی تا باز ملایم داریم:
![]()
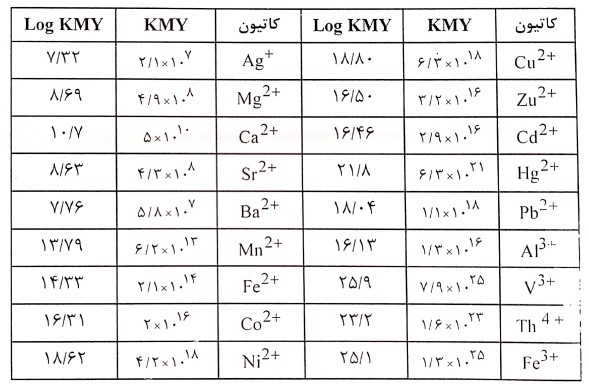
کلیه کاتیون ها حداقل تا حدودی با EDTA واکنش می دهند (بجز در مورد فلزات قلیایی) کمپلکس های حاصل دارای پایداری کافی جهت استفاده در تجزیه های حجمی می باشند. بدون شک این پایداری زیاد ناشی از وجود چند گروه کمپلکس کننده در مولکول است که منجر به ایجاد ساختمان هایی می شوند که به طور مؤثری کاتیون را احاطه و منزوی می کنند. یک شکل از کمپلکس در شکل b ارائه شده است. همان طور که مشاهده می گردد تمام شش گروه لیگاند در EDTA برای ایجاد پیوند با یون فلز دو والانسی درگیر شده اند. همچنین در جدول c لیست ثابت های تشکیل (KMY) برای کمپلکس های متداول EDTA آورده شده است.