قلیائیت آب
قلیائیت آب :
ظرفیت آب برای خنثی سازی اسید را قلیائیت می نامند. بنابراین، قلیائیت برخلاف اسیدیته، یعنی ظرفیت آب برای خنثی سازی باز، است. قلیائیت آب های طبیعی عمدتاً مربوط به نمک های اسیدهای ضعیف است، لیکن بازهای ضعیف یا قوی نیز ممکن است در آن مشارکت داشته باشند. بی کربنات ها عمده ترین بخش قلیائیت در آب های طبیعی اند، ولی نمک های اسیدهای ضعیف دیگر، همچون کربنات ها، سیلیکات ها، فسفات ها و بورات ها نیز ممکن است در آب به مقدار جزئی وجود داشته باشد. در آب های طبیعی، بعضی اسیدهای آلی طبیعی، مثل هیومیک اسیدها، نمک هایی تشکیل می دهند که عامل قلیائیت اند. در آب های آلوده و کم اکسیژن نیز ممکن است اسیدهای ضعیف، همچون استیک اسید، پروپیونیک اسید و هیدروژن سولفید تولید شوند که متقابلاً نمک تشکیل شدۀ آنها در مقدار قابلیت آب سهیم اند. آمونیاک و هیدروکسیدها نیز میزان قلیائیت آب مشارکت دارند. تعدادی از واکنش های خنثی سازی اسید توسط عوامل قلیائیت عبارت اند از:

اندازه گیری قلیائیت:
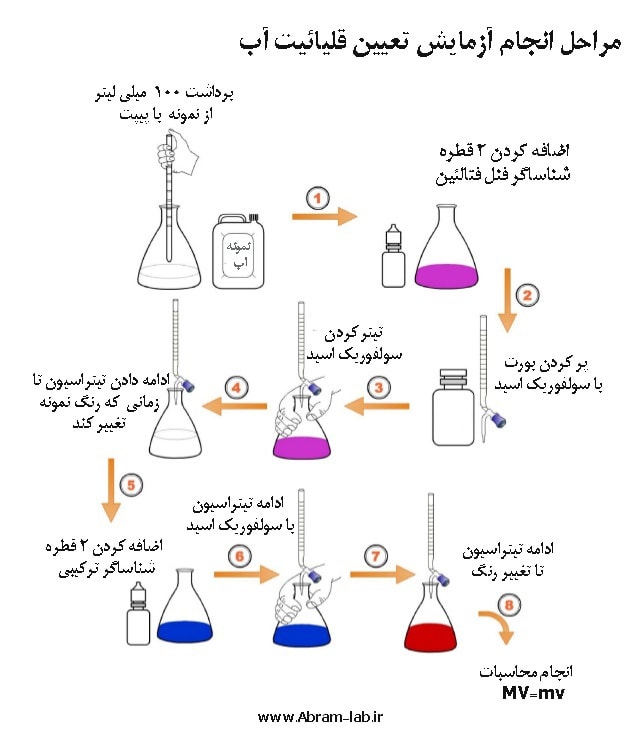
قلیائیت را از طریق تیترسنجی نمونه آب با یک اسید استاندارد تا رسیدن به نقطۀ نهایی pH اندازه گیری می کنند. معمولاً دو نقطۀ نهایی pH، یکی 8.3 برای اندازه گیری قلیائیت فنل فتالئین و دیگری حدود 4.5 برای اندازه گیری قلیائیت کل، به کار می رود. در هنگام تیترسنجی، نقطۀ نهایی pH با پی اچ سنج یا نشانگر رنگی که در نقطه نهایی pH تغییر رنگ می دهد، کنترل می شوند.
با توجه به حجم اسد مصرف شده، غلظت قلیائیت آب از معادله زیر به دست می آید:
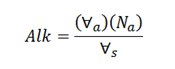
که در آن، Alk قلیائیت (eq/L)، حجم اسید مصرف شده در تیترسنجی برای رسیدن به نقطۀ نهایی pH (mL)، Na نرمالیته اسید مصرف شده (eq/L) و حجم نمونۀ آب (mL) است. چنانچه طرف راست رابطۀ بالا در عدد 50000 ضرب شود، غلظت قلیائیت برحسب mg/L as CaCO3 به دست می آید.
منابع قلیائیت:
کانی های کربناتی (عمدتاً سنگ آهک)، منبع اصلی قلیائیت در بسیاری از آب های طبیعی هستند. حل پذیری کانی های کلسیت (کانی CaCO3) و دولومیت (کانی CaCO3MgCO3) در آبی که در تماس با جوّ نباشد، اندک است؛ لیکن در حضور CO2 حل پذیری آنها، طبق واکنش های زیر، به مقدار زیادی افزایش می یابد:

در واکنش های تعادلی بالا، برای تشکیل بی کربنات، باید CO2 در محلول موجود باشد. بر اثر تغییر مقدار CO2، مقدار یون بی کربنات نیز تغییر می کند. افزایش CO2 به بیش از حدّ تعادل به حل پذیری بیشتر کلسیم کربنات و بالا رفتن سطح قلیائیت آب می انجامد؛ برعکس، کاهش CO2 به ترسیب کلسیم کربنات منجر می شود و قلیائیت آب را کاهش می دهد.
منبع دیگر بی کربنات ها در آب، واکنش های تبادل یون به یون هیدروژن در آب و کاتیون های درگیر در رسوبات است.
![]()
در چنین واکنش هایی، CO2 لازم، از تخریب مواد آلی یا از جوّ تأمین می شود. به علت این واکش ها، آب حتی وقتی روی سطح خاک عاری از کانی های کربناتی نیز قرار می گیرد، قلیائیت کسب می کند.
مقدار قلیائیت آب های طبیعی:
مقدار قلیائیت آب های طبیعی از حدود صفر تا بیش از mg/L as CaCO3 500 متغیر است؛ به طوری که بر مبنای غلظت قلیائیت، آب های طبیعی را می توان به پنج گروه تقسیم کرد: بسیار کم قلیائیت با غلظت کمتر از 10، کم قلیائیت با غلظت بین 10 تا 50، میان قلیائیت با غلظت بین 50 تا 150، پُرقلیائیت با غلظت بین 150 تا 300 و بسیار پُرقلیائیت با غلظت بیش از mg/L as CaCO3 300.
غلظت قلیائیت در لجناب هاضم های بی هوازی که به خوبی بهره برداری شوند در گستره 2000 تا mg/L as CaCO3 4000 است. تاکنون، استانداردی بر حدّ مجاز قلیائیت در آب آشامیدنی ارائه نشده و در آب شهری تا mg/L as CaCO3 500 هم مجاز است.
در آب های طبیعی، معمولاً هرچه قلیائیت بیشتر باشد، pH نیز بیشتر می شود؛ به طوری که pH آب های بسیار کم قلیائیت (کمتر از حد اندازه گیری) معمولاً کمتر از 5، کم قلیائیت بین 5 تا 7، متوسط تا پُرقلیائیت بین 7 تا 8.5 و بسیار پُرقلیائیت، 9 یا بیشتر است.
شکل های قلیائیت در آب:
قلیائیت کل آب شامل رادیکالهای هیدروکسید،کربنات ها و بیکربنات ها و در برخی مواقع شامل فسفات ها ، بورات ها و سیلیکات ها میباشد. شناساگرهای مورد استفاده در تعیین قلیائیت آب عبارتند از فنل فتالئین و متیل اورانژ. تیتراسیون معمولا با یک اسید قوی استاندارد نظیر اسید سولفوریک و اسید کلریدریک انجام میشود. در تیتراسیون با فنل فتالین ، اگر رنگ شناساگر که در داخل محلول نمونه به علت محیط قلیائی ارغوانی باشد و در 8.3 =PH بیرنگ شود، مقدار اسید مصرفی خنثیسازی قلیائیت ناشی از هیدروکسید و کربنات را نشان میدهد.
اگر به این نمونه چند قطره متیل اورانژ اضافه شود، رنگ محیط نارنجی زرد خواهد شد که با تیتراسیون توسط اسید در 4.5 = PH رنگ محلول سرخ خواهد شد. این مقدار اسید در واقع برای خنثی سازی بیکربناتها بکار رفته است. مجموع قلیائیتهای فنل فتالین و متیل اورانژ را قلیائیت کل مینامند و با علامت اختصاری T نشان میدهند.
T = P + M
کلر به شکل اسیدهیپوکلروس و اسید هیپوکلریک با قلیائیت موجود در آب واکنش می دهد. به نحویکه یک قسمت کلر با قسمت های آلکانیتی ترکیب می شود. این آلکانیتی با اضافه نمودن 1.2 میلی گرم در لیتر آلکانیتی بر حسب کربنات کلسیم جبران می شود. به عبارت دیگر کلریناسیون با استفاده از هیپوکلریت سدیم یا کلسیم مقداری قلیائیت به آب اضافه می نماید.در رابطه بالا M بیانگر اسید مصرفی برای خنثی کردن بیکربنات ها و P اسید مصرفی برای خنثی کردن هیدروکسید و کربنات و T قلیائیت کل است.
برای افزایش قلیائیت بر حسب کربنات کلسیم، می توان از بیکربنات سدیم استفاده نمود. بطوریکه افزودن 1.5پوند معادل 680 گرم بیکربنات سدیم به 10000 گالن، 10 میلی گرم در لیتر آلکانیتی را افزایش میدهد. برای کاهش دادن 10 میلی گرم در لیتر آلکانیتی، افزودن 850 گرم بی سولفات سدیم 0.825 لیتر اسید موریاتیک به 38 مترمکعب آب توصیه می شود. همچنین 453 گرم کلرور کلسیم در 38 مترمکعب آب سختی را به میزان 11 میلی گرم در لیتر بر حسب کربنات کلسیم افزایش خواهد داد . آلکانیتی متیل اورانژ بین 80 و 120 میلی گرم در لیتر حفظ گردد.










سلام الان یک سوال مطرح هست و اون هم اینکه وقتی کلر زیاد میشه تو آب بویلر، می توان با افزایش قلیائیت اون رو کم کرد؟ یعنی با افزودن هیپوکلریت سدیم یا کلسیم؟
سلام خیر نمیشه