کل هالوژن آلی (TOX) در آب
کل هالوژن آلی (TOX) در آب
پارامترهای هالوژن آلی (TOX) بیانگر غلظت هالوژن های مفید در مواد آلی محلول در آب است. حضور مولکول های آلی هالوژندار در آب، نشانگر وجود محصولات جانبی گندزدایی (DBPs) و دیگر آلاینده های سنتزی در آن است. مقدار کل هالوژن آلی (TOX) در آب، از نظر پتانسیل مخاطرات بهداشتی برای انسان و ناسالم محیط زیست دارای اهمیت است.
برخی از ترکیبات آلی هالوژن دار مهم سهیم در کل هالوژن آلی (TOX) آب شامل:
- تری هالومتان ها (THMs)،
- حلال های آلی همچون تری کلرواتیلن (TCE) و تتراکلرواتیلن (PCE)،
- آفت کش ها و علف کش های کلردار و برم دار،
- پلی کلرینتد بی فتیل ها (PCBs)،
- آروماتیک های کلردار همچون هگزاکلروبنزن و 2،4- دی کلروفنول (2,4-dichlorophenol (C6H4C12O)) و
- مواد گیاخاکی کلردار

روش متداول اندازه گیری کل هالوژن آلی (TOX) در آب، روش جذب سطحی تف کافت/ تیترسنجی است. در این روش که شامل چهار فرآیند است، اول، ترکیبات آلی هالوژن دار بر جذب کربن فعال می شوند. دوم، کربن فعال (activated carbon) عاری از هالید معدنی می شود. سوم، تحت فرآیند تف کافت (pyrolysis) مولکول های آلی شکسته و هالوژن های آنها به هیدروژن هالید (hydrogen halide, hydrohalic acid (HX)) تبدیل می شود و چهارم، غلظت هالوژن ها با روش تیترسنجی اندازه گیری می شود.
تعریف هالوژن
کلمه هاوژن به معنای “نمک ساز” است. وقتی هالوژن ها با فلزات واکنش نشان می دهند، طیف وسیعی از نمک ها از جمله فلوراید کلسیم، کلراید سدیم (نمک معمولی خوراکی)، بروماید نقره و یداید پتاسیم را تولید می کنند. گروه هالوژن ها تنها گروه جدول تناوبی است که حاوی عناصری در سه حالت اصلی ماده (جامد، مایع و گاز) در دما و فشار استاندارد است. همه هالوژن ها با اتصال به هیدروژن، اسید تشکیل می دهند. بیشتر هالوژن ها معمولاً از مواد معدنی یا نمک تولید می شوند. هالوژن های میانی – کلر، برم و ید – اغلب به عنوان ضد عفونی کننده استفاده می شوند. ارگانوبرومیدها مهم ترین دسته از بازدارنده های شعله هستند، در حالی که هالوژن های عنصری خطرناک هستند و می تواند سمی باشند.
تاریخچه هالوژن کل هالوژن آلی (TOX) در آب
فلوئورسپار معدنی فلوئور در اوایل سال 1529 شناخته شد. در ابتدا شیمیدانان متوجه شدند که ترکیبات فلوئور حاوی یک عنصر کشف نشده است، اما قادر به جداسازی آن نبودند. در سال 1860، جورج گور، شیمیدان انگلیسی، جریان الکتریسیته را از طریق اسید هیدروفلوئوریک عبور داد و احتمالاً فلوئور را تولید کرد، اما در آن زمان نتوانست نتایج خود را ثابت کند. در سال 1886، هنرسی مویسان (Henri Moissan)، شیمیدان پاریسی، الکترولیز را بر روی بی فلوراید پتاسیم محلول در هیدروژن فلوراید بی آب انجام داد و با موفقیت فلوئور را جدا کرد.
اسید هیدروکلریک برای کیمیاگران و شیمیدانان از قبل شناخته شده بود. با این حال، کلر عنصری تا سال 1774 تولید نشد، زمانی که کارل وبلهلم شیله (Carl Wilhelm Scheele) اسید کلریدریک را با دی اکسید منگنز گرم کرد. شیل این عنصر را «اسید موریاتیک دفلوژیستی شده» نامید که به این ترتیب کلر برای 33 سال شناخته شد. در سال 1807، هامفری دیوی (Humphry Davy) کلر را بررسی کرد و متوجه شد که یک عنصر واقعی است. ترکیب کلر با اسید کلریدریک و همچنین اسید سولفوریک در موارد خاص گاز کلر را ایجاد می کند که در طول جنگ جهانی اول به عنوان یک گاز سمی مورد استفاده قرار می گرفت.
برم در دهه 1820 توسط آنتوان جروم بالارد (Antoine Jerome Balard ) کشف شد. بالارد با عبور گاز کلر از نمونه آب نمک، برم را کشف کرد. او در ابتدا نام muride را برای عنصر جدید پیشنهاد کرد، اما آکادمی فرانسه نام عنصر را به برم تغییر داد.
ید توسط برنارد کورتوا (Bernard Courtois)، که از خاکستر جلبک دریایی به عنوان بخشی از فرآیند تولید نمک خوراکی استفاده می کرد، کشف شد. کورتوا معمولاً خاکستر جلبک دریایی را با آب می جوشاند تا کلرید پتاسیم تولید کند. با این حال، در سال 1811، کورتوا اسید سولفوریک را به فرآیند خود اضافه کرد و متوجه شد که فرآیند او بخارهای بنفش رنگی تولید می کند که به کریستال های سیاه متراکم می شود. کورتوا با مشکوک شدن به اینکه این کریستال ها عنصر جدیدی هستند، نمونه هایی را برای بررسی به شیمیدانان دیگر فرستاد. جوزف گی لوساک (Hosegh Louis Gay – Lussac) ثابت کرد که این ید عنصر جدیدی است.
در سال 1931، فرد آلیسون (Fred C.Allison) ادعا کرد که عنصر 85 را با یک دستگاه مغناطیسی نوری کشف کرده است و نام عنصر را آلابامین گذاشت، اما او اشتباه کرد. در سال 1937، راجندرالال دی (Rajendralal De) ادعا کرد که عنصر 85 را در مواد معدنی کشف کرده است و عنصر را داکین نامید، اما او نیز در اشتباه بود. تلاش برای کشف عنصر 85 در سال 1939 توسط Horia Hulubei و Yvette Cauchois از طریق طیف سنجی نیر ناموفق بود، همین طور، در همان سال والتر مایندر یک عنصر ید مانند را که از تجزیه بتا پلونیوم کشف کرد، ناموفق بود. عنصر 85 که اکنون استاتین نامیده می شود، با موفقیت در سال 1940 توسط دیل آر کورسون (Dale Ramond Corson)، کی آر مکنزی (Kenneth Ross Mackenzie) و امیلیو جی. سگره (Emilio Gino Segrè) کشف شد.
خصوصیات شیمیایی
هالوژن های فلوئور، کلر، برم و ید غیر فلز هستند. خواص شیمیایی دو عنصر سنگین ترین گروه 17 به طور قطعی بررسی نشده است. هالوژن ها روندهایی را در انرژی پیوند شیمیایی نشان می دهند که از بالا به پایین ستون جدول تناوبی حرکت می کند و در این میان فلوئور کمی انحراف دارد. این روند نشان دهنده بالاترین انرژی پیوند در ترکیبات با اتم های دیگر می باشد، اما پیوند های بسیار ضعیفی در مولکول F2 دو اتمی دارد. این بدان معناست که پایین تر از گروه 17 در جدول تناوبی، واکنش پذیری عناصر به دلیل افزایش اندازه اتم کاهش می یابد.
هالوژن ها بسیار واکنش پذیر هستند و به همین دلیل می توانند در مقادیر بالا، برای موجودات بیولوژیکی مضر یا کشنده باشند. این واکنش پذیری بالا به دلیل الکترونگاتیوی بالای اتم ها به دلیل بار هسته ای موثر بالا است. از آنجایی که هالوژن ها دارای هفت الکترون ظرفیتی در بیرونی ترین سطح انرژی خود هستند، می توانند با واکنش با اتم های عناصر دیگر، یک الکترون به دست آوردند تا قاعده اکتت (octet rule) را برآورده کنند. فلوئور واکنش پذیرترین عنصر در میان همه عناصر است. این عنصر تنها عنصر الکترونگاتیوتر از اکسیژن است، به مواد بی اثر مانند شیشه حمله می کند و با گازهای خاص معمولاً خنثی ترکیباتی را تشکیل می دهد. خورنده استو گاز بسیار سمی واکنش پذیری فلوئور به گونه ای است که در صورت استفاده یا نگهداری در ظروف شیشه ای آزمایشگاهی، می تواند با شیشه در وجود مقادیر کمی از آب واکنش داده و تترا فلوراید سیلیکون (SiF4) را تشکیل دهد. بنابراین، فلوئور باید با موادی مانند تفلون (که خود یک ترکیب ارگانوفلوئورین است)، شیشه بسیار خشک یا فلزاتی مانند مس یا فولاد که یک لایه محافظ از فلوراید را بر روی سطح آنها تشکیل می دهند، استفاده شود. واکنش پذیری بالای فلوئور باعث می شود که با برخی ترکیبات به ویژه کربن، قوی ترین پیوندهای ممکن داشته باشد. به عنوان مثال تفلون با فلوئور و کربن پیوند می خورد و در برابر حملات حرارتی و شیمیایی بسیار مقاوم است و نقطه ذوب بالایی دارد.
مولکول های هالوژن دو اتمی
هالوژن های پایدار مولکول های دو اتمی هسته ای را تشکیل می دهند. به دلیل نیروهای بین مولکولی نسبتاً ضعیف، کلر و فلوئور بخشی از گروهی هستند که به عنوان “گازهای عنصری” شناخته می شوند.
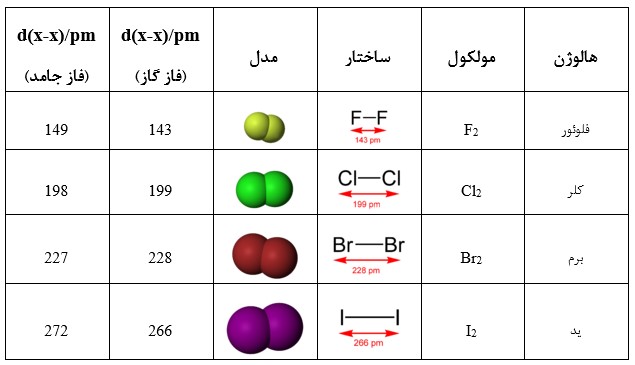
با افزایش عدد اتمی، عناصر کمتر واکنش پذیر می شوند و نقطه ذوب بالاتری دارند. نقاط ذوب بالاتر ناشی از نیروهای پراکندگی لندن قوی تر ناشی از الکترون های بیشتر است.










