آزمایش PH
آزمایش PH
آزمایش pH یکی از مهم ترین و رایج ترین آزمون های شیمیایی می باشد. آزمایش pH نشانگر میزان اسیدی بودن یا اسیدی نبودن نمونه می باشد. pH در اندازه گیری قلیائیت، کربن دی اکسید و دیگر تعادلات اسیدی و بازی مؤثر می باشد. در دمای مشخص شدت اسیدی یا بازی بودن نمونه با pH یا فعالیت یون هیدروژن مشخص می شود. قلیائیت و اسیدیته ظرفیت خنثی سازی اسید و باز در آب می باشد.
آب خالص به مقدار خیلی جزئی یونیده می شود؛ در نتیجه، یون های هیدروژن آبدار به صورت H3O+، H5O+ و به صورت کلی H2O)nH+) تشکیل می شوند. واکنش ساده شده یونش آب را می توان به صورت زیر نوشت:
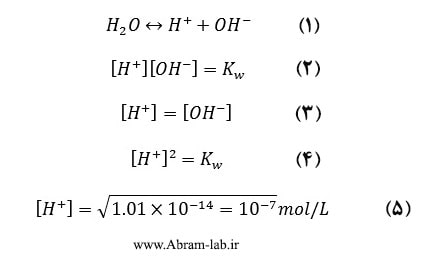
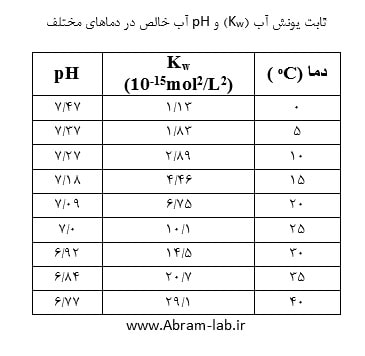
ثابت یونش آب (Kw) به صورت معادله 1 می باشد. ثابت یونش واکنش به صورت معادله 2 می باشد. مقدار Kw به دمای آب بستگی دارد و با افزایش دما، افزایش می یابد (جدول زیر). در آب خالص، با توجه به اصل الکتروخنثایی معادله 3 را داریم.برای آب خالص و در دمای C ͦ 25 معادله 5 تصویر بالا صادق است.
با افزایش آلاینده های اسیدیه به آب، غلظت یون هیدروژن آب افزایش و غلظت یون هیدروکسید کاهش می یابد. برعکس، با افزایش آلاینده های قلیایی به آب، غلظت یون هیدروکسید افزایش و غلظت یون هیدروژن کاهش می یابد.
آزمایش PH
برای بیان شرایط اسیدی یا قلیایی یک محلول به کار می رود. آب های طبیعی، دارای هر دو ترکیبات اسیدی و قلیایی هستند، به طوری که بر هم کنش این ترکیباتِ متضاد و نیز فرایندهای شیمیایی و زیستی در آب، pH نهایی آب را نتیجه می دهد. با لگاریتم گرفتن از رابطه و ضرب طرفین آن در علامت منفی داریم:

مطابق شکل بالا ، با لگاریتم گرفتن از رابطه A و ضرب طرفین آن در علامت منفی داریم رابطه B و سپس می توان معادله بالا را به صورت معادله C نوشت. در نتیجه برای آب خالص در دمای C ͦ 25 معادله F که نتیجه معادله ها می باشد بدست می آید.
با افزایش آلاینده هایی که هیدروژن یا هیدروکسید در آب آزاد می کنندpH آب تغییر می کند. آلاینده های آزاده کنندۀ یون هیدروژن و کاهش یون هیدروکسید را موجب می شود. ، که در این شرایط، pH محلول کمتر از 7 می شود. برعکس، آلاینده های آزاد کنندۀ هیدروکسید ، باعث کاهش غلظت یون هیدروژن و افزایش پی اچ می شود. محدوده pH معمولاً از صفر تا 14 است، اما وجود مقادیر کمتر از صفر و بیشتر از 14، به ترتیب در محلول های اسیدی و بازی یا بازی غلیظ ممکن است. در دمای C ͦ 25، مجموع pH و pOH، برابر است.
اهمیت pH
pH در بسیاری از جنبه های مهندسی محیط زیست نقش مهمی ایفا می کند. بسیاری از واکنش هایی که بر کیفیت آب تأثیر می گذارند، به pH بستگی دارند. در تصفیۀ آب و فاضلاب، pH روی کارایی فرایندهای شیمیایی و میزان مصرف مواد شیمیایی لازم در آنا و نیز کنترل فرایندهای زیستی تأثیر گذار است. درضمن pH بر کاربری های آب تأثیر می گذارد. آب های با pH کم یا زیاد، خورنده اند؛ بدین دلیل برای به حداقل رساندن خورندگی لوله های انتقال آب های اسیدی در مبدأ، به آب آهک افزوده می شود. مقدار استاندارد آب آشامیدنی، مقدار pH را بین 6.5 و 8.5 تعیین کرده است. بالا یا پایین شدن از این مقدار برای شرب غیر مجاز بوده و اثرات سو و بیماری در بدن ایجاد می کند. لذا بایستی همواره در تعیین مقدار آن نهایت دقت به عمل آورد.
در اکوسیستم های آبی، pH آب دارای اهمیت است؛ زیرا بر زندگی آبزیان تأثیر می گذارد. در آب های اسیدی و قلیایی آبشش ماهیان صدمه می بینند، به طوری که pH کمتر از 4 یا بیشتر از 9، باعث مرگ آنها می شود. در pH کمتر از 6.5 تولید مثل ماهیان و برخی از دیگر حیوانات آبزی متوقف می شود. به طور کلی، منابع آب باید به گونه ای در مقابل آلاینده های اسیدی یا قلیایی محافظت شوند که pH آنها بین 6.5 و 8.5 باقی بماند. اکثر آبهای طبیعی دارای pH نزدیک به خنثی و در 95 درصد از آنها، pH بین 6 تا 9 است.
مقدار pOH، یا غلظت یون هیدروکسیل، در واکنش های رسوب دهی ناشی از تشکیل هیدروکسیدها از اهمیت خاصی برخوردار است. در این مورد کاهش یون منیزیم در فرایند سختی زدایی آب با افزودن آهک و نیز فرایندهای انعقاد شیمیایی با استفاده از نمک های آهن و آلومینیم را می توان مثال زد. اسیدهای ضعیف، بازهای ضعیف و نمک های آنها، در آب یونیده می شوند و بین گونه های یونیده و نایونیده آنهاتعادل برقرار می شود. pH محلول، نقش مهمی در توزیع نسبی گونه های یونیده و نایونیده این ترکیبات دارد.
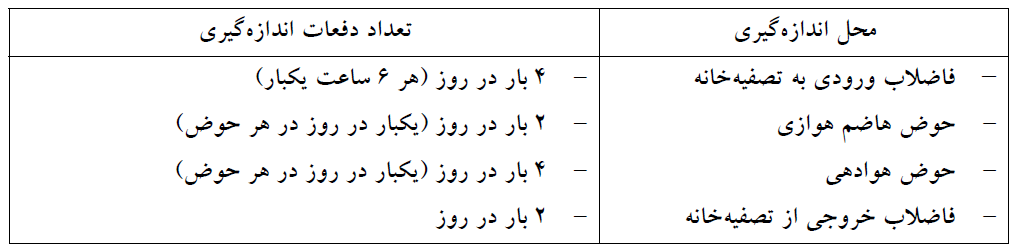
نقاط اندازه گیری پی اچ در تصفیه خانه
دستگاه اندازه گیری پی اچ آب











