آزمایش قلیاییت آب
آزمایش قلیاییت آب :
برای آزمایش قلیاییت آب آشامیدنی مقداری کربنات و بی کربنات به صورت کربنات سدیم ، بی کربنات سدیم ،و بی کربنات منیزیم وجود دارد. همچنین به ندرت سیلیکاتها و فسفات ها در آب دیده می شوند که در این صورت این یون ها نیز در قلیاییت آب موثر می باشند. منظور از آزمایش قلیاییت آب ، ظرفیت آب در خنثی کردن یک اسید تا رسیدن به یک PH مشخص (8.3 -4.4) است. علاوه بر عوامل قلیاییت آب که در بالا به آنها اشاره کردیم ، وجود بی بوراتها ، بی فسفات ها و بی سیلیکاتها ( که به ميزان كم درآبها وجود دارند) نیز باعث افزایش قلیاییت آب می شود. علاوه بر آن وجود گازهايي كه تحت شرايط خاصي در آب حل شده و توليد يون مي كنند نظير CO2 و NH3 ،نيز بر ميزان قليائيت اثر دارد. به طور مثال در چاه هاي عميق گاز NH3 در آب به صورت زير حل شده توليد يون مي كند :
NH3 + H2O → NH4+ + OH
میزان قلیاییت در فرآیند های شیمیایی آب و فاضلاب نظیر نرم کردن آب ،حذف آهن و خنثی سازی PH اهمیـت دارد. لازم به ذکر است از آنجـایی که تنـها در PH بالای 9.5 ، OH وجود دارد در آب های طبیعی معمولاً یون هیدروکسید(–OH) یافت نمی شود و اصطلاح قلیاییت با تعادل کربنات پیوسته است . مهمترین منبع ورود کربنات CO2 هوا و سنگ آهک CaCO3 است.
در نمونه ی دارای یون هیدروکسید، پی اچ PH در حدود 9.5 به بالا می باشد. اگر میزان PH و حجم اسید اضافه شده برای خنثی کردن عامل قلیاییت را در نموداری به صورت زیر نمایش دهیم ذکر نکاتی در مورد این نمودار ضرورت پیدا می کند. لازم به ذکر است که جهت رسم نمودار ، بدست آوردن مقادیر PH توسط دستگاه PHمتر صورت می گیرد.
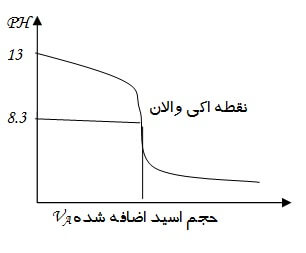
همانگونه که درشکل نیز مشخص است نمودار دارای نقاطی است که شیب منحنی در آن به طور قابل توجهی تغییر یافته است، تعدادی از این نقاط نشان دهنده ی تغییر عامل قلیاییت و نقطه ی دیگر، نقطه ی خنثی شدن ، نقطه ی هم ارزی یا نقطه ی اکی والان است که در وسط خط با شیب تند قرار گرفته است.
برای عمل تیتر کردن نمونه از اسید هیدروکلریک HCl با درصد 0.02N استفاده می شود. در آبی که دارای یون های هیدروکسید (OH–) کربنات (CO32-) و بیکربنات (HCO3–) می باشد با شروع عمل تیتراسیون همواره ابتدا یونی شروع به واکنش می کند که قلیاییت بیشتری دارد. که در نمونه ی ما یون هیدروکسید دارای بیشترین قلیاییت است . تا زمانی که یون OH– در محلول وجود دارد PH با اضافه کردن اسید تغییر چندانی نمی کند، و کاهش تدریجی دارد . تا جایی که تمامی یون های هیدروکسید از آب خارج شوند و اکی والان OH– و H+ برابر شوند ، که این فرآیند بر روی نمودار وسط خط با شیب تند یا همان نقطه ی هم ارزی مشخص می شود.
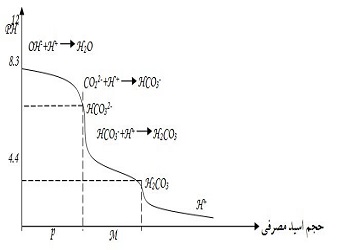
پس از عامل قلیاییت OH– ، یون کربنات (CO32-)که قلیلییت بیشتری نسبت به بیکربنات (HCO3–) دارد، وارد واکنش می شود، این فرآیند در PHحدود 9.5 شروع میشود و تا PH حدود 8.3 ادامه می یابد. تا این مرحله نیمی از کربنات مصرف و به یون بی کربنات تبدیل می شود. بر روی نمودار فوق نیز تغییر عامل قلیاییت کربنات به وضوح قابل مشـاهده اسـت. از ایـن زمـان به بـعد یـون بـی کربـنات وارد واکـش می شـود وتبـدیـل به CO32 می شود، تا PH حوالی 4.4 دیگر عامل قلیاییت در محیط واکنش باقی نمی ماند.
قلیاییت عملا توسط مقدار اسید مورد نیاز تا رسیدن به نقطه ی اکی والان مشخص می شود، جهت مشخص شدن اولین نقطه ی اکی والان تا PH برابر 8.3 اغلب از معرف رنگی فنل فتالیین استفاده می شود . قلیاییت محاسبه شده تا این PH ، قلیاییت فنل فتالیین نامیده می شود .به کمک اسید مصرفی تا رسیدن به PH=4.5 (از 8.3= PH )، قلیاییت متیل اورانژ محاسبه می شود و مجموع این دو قلیاییت ، قلیاییت کل نامیده می شود.
در قلیاییت آبهای طبیعی و تصفیه شده ترکیباتی نظیر کربنات و بی کربنات و همچنین هیدروکسید ها ، باید در نظر گرفته شوند. در تیتراسیون به کمک فنل فتالئین همه ی هیدروکسید ها و نیمی از کربنات ها تیتر می شوند.در مجاورت متیل اورانژ ،بی کربناتها تیتر می شوند( کربناتها به بی کربنات ها تبدیل می شوند ).در تیتراسیون در مجاورت متیل اورانژ ، بی کربنات ها تیتر می شوند.در صورتی که بخواهیم قلیاییت کل را با یک بار تیتراسیون مشخص کنیم از ابتدا از معرف متیل اورانژ استفاده می کنیم.
به طور کلی آزمایش قلیاییت آب ممکن است بصورت یکی از 5 حالت زیر باشد :
- قلیاییت فقط مربوط به هیدروکسیداست
- قلیاییت مربوط به هیدروکسید و کربنات است.
- قلیاییت فقط مربوط به کربنات است .
- قلیاییت مربوط به کربنات وبی کربنات است.
- قلیاییت فقط مربوط به بیکربنات است.
آزمایش قلیاییت آب را میتوان به کمک محلول اسید سولفوریک 0.02 N نیز تعیین کرد.










