تهیه محلول بافر
تهیه محلول بافر
به طور کلی برای تهیه محلول بافر ، ابتدا توصیحات مختصری در مورد محلول بافر ارائه میدهیم و سپس نحوه انتخاب و تهیه محلول بافر را شرح میدهیم. بافر محلولی است که در برابر افزایش اسید یا باز مقاومت نموده و مانع تغییرات شدید pH میشود محلول تامپون است که شامل دو دسته کلی زیر میشود.
- تامپون اسید قوی یا باز قوی
- تامپون ناشی از مخلوط اسید- باز ضعیف مزدوج
از مشخصه های مهم بافر، نیروی بافر یا نیروی تامپونی است.
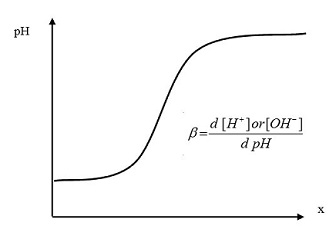
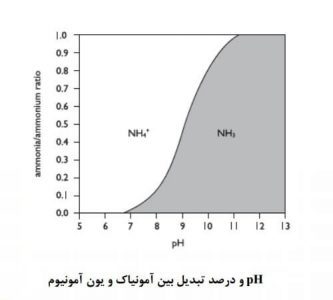
به عنوان نمونه منحنی تیتراسیون اسیدیمتری یک اسید ضعیف را در نظر داشته باشید. در x=0.5 یعنی هنگامی که غلظت گونه باز و اسید برابر است طبق رابطه هندرسون – هاسلباخ pH= pKa خواهد بود. در این نقطه شیب منحنی نزدیک صفر است و بنابراین مشاهده میشود تغییرات pH نسبت به تغییرات غلظت باز بسیار کم است. همین موارد درباره یک باز ضعیف هم صادق است.
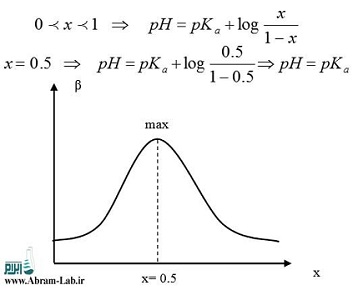
همانطوریکه در منحنی دیده میشود بیشترین نیروی تامپون در x= 0.5 حاصل میشود. این بدین معنی است که هر چه غلظت گونه اسید و باز سازنده تامپون نزدیکتر باشد تامپون قویتر است.
انتخاب و تهیه محلول بافر
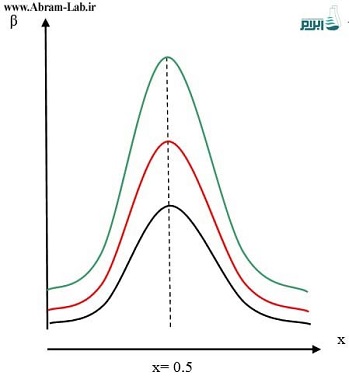
در نمودار زیر بر اساس (ASTM D 1126) سه منحنی تامپون دیده میشود. همانطوریکه دیده میشود هر سه تامپون در x=0.5 نیروی تامپونی حداکثر دارند با این حال بهترین تامپون، تامپونی است که منحنی کوچکتری دارد. اصولاً در شیمی تجزیه سعی بر آن است که محلولها دارای حداقل غلظت باشند چراکه در اثر افزایش غلظت نیروهای یونی افزایش یافته و قوانین و تئوریهای شیمیایی و در نتیجه پیشبینی وقایع و محاسبات دچار عدم صحت کافی خواهند شد. بنابراین معمولاً سعی بر این است که از تامپونی استفاده شود که دارای بیشترین مقاومت و حداقل غلظت باشد. البته موارد استثنایی هم وجود دارد مانند محلول تامپون برای آزمایش سختی است که غلظت آن بالاست.