تیتراسیون اسید ضعیف با باز قوی
تیتراسیون اسید ضعیف با باز قوی
در تیتراسیون اسید ضعیف با باز قوی و تیتراسیون ph متری اسید ضعیف و باز قوی باید بیلان غلظت پیش از شروع تیتراسیون و بیلان غلظت پس از شروع تیتراسیون محاسبه گردد و پس از نقطه تعادل Equilibrium point مازاد غلظت – OH به صورت Cx-C یا (C(x-1 بیان میشود. برای محاسبات مربوط به تیتراسیون ph متری اسید ضعیف و باز قوی طبق روش زیر عمل می کنیم و بر اساس روش کار تیتراسیون فضای کار آماده می گردد.
HA + OH–(aq) <=> A–(aq) + H2
0 0 C
C-CX CX CX
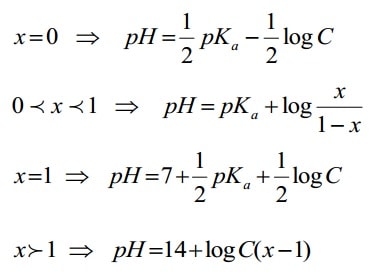
برای تشخیص و برآورد امکان تیتراسیون اسید ضعیف با توجه به غلظت و pKa موارد زیر بررسی میشود:
- pH در نقطه x=0.5 یعنی نیمه راه خنثی شدن حساب شود. pH = pKa
- pH در نقطه x=2 را با توجه به رابطه pH حساب شود.
- منحنی Acidimetry را به طور تقریبی رسم شود.( تهیه محلول استاندارد بافر )
- اگر جهش مابین دو سکو (یعنی سکوی مربوط به نیمه راه خنثی شدن pH = pKa و مازاد باز) 4 یا بیشتر از چهار باشد چنانچه شناساگری با حد انحراف ±0.1 واحد از pH نقطه تعادل به کار رود تیتراسیون با خطای کمتر از 1%± قابل انجام است و قلیائیت کل قابل محاسبه است.
شرط حد براي تیتراسیون اسید ضعیف با باز قوی اين است كه شناساگري با حد انحراف ±0.1واحد از pH نقطه تعادل به كار رود در اين حالت تیتراسیون با خطاي حداكثر % ±1قابل انجام است.
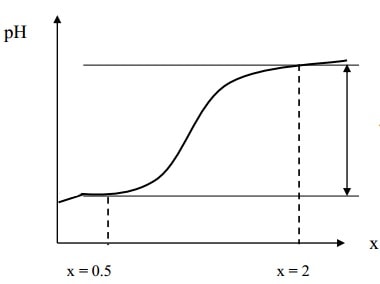
معمولاً اسیدهای ضعیفی که در شیمی تجزیه کلاسیک تیتر میشوند غلظتی در حدود 0.1M دارند. بنابراین با استفاده از روابط به دست آمده اگر حدود غلظتی 0.1M باشد اسیدهایی قابل تیتراسیون اسیدیمتری هستند که pKa آنها کمتر از 9 و حداکثر 9 باشد. البته اگر غلظت به 0.01 و 0.001 کاهش یابد حد pKa به ترتیب به 8 و 7 کاهش خواهد یافت. (طبق اصل لشاتلیه هر چه غلظت اسید ضعیف کاهش یابد رفتارش مشابه اسید قوی خواهد شد)