روش کار تیتراسیون
روش کار تیتراسیون
دقت عمل در روش کار تیتراسیون بسیار با اهمیت می باشد چراکه یکی از مهمترین و متداولترین روشهای اندازه گیری کمی در آزمایشـگاه هـای شـیمی، حجـم سـنجی (تیتراسیون) است، که مـوارد کـاربرد گونـاگونی دارد. ماننـد تیتراسـیون اسـید- بـاز، اکسـایش- کـاهش (منگانومتری، یدومتری و …)، کمپلکسومتری، رسوبی، و… در تجزیه حجم سنجی، یک محلول با یک محلول دیگر، واکنش می دهد و تعیین حجم هـای معـادل دو ماده شرکت کننده در واکنش، مورد نظر است. برای تعیین پایان واکنش (نقطه خنثی شدن) معمولا از یـک شناساگر مناسب استفاده میشود.
غلظت یک محلول معین، در نمونه هایی از آن با حجم های متفاوت ثابت است. ولی مقـدار مـاده حـل شده در هر یک از این نمونه ها متفاوت است. روش کار تیتراسیون به این شکل می باشد که غلظتهای مولار یا نرمال، مقدار ماده حل شده موجـود در یک لیتر از محلول را بیان میکنند. برای تعیین تعداد مولها و یا تعداد هم ارزها (اکـی والان گـرم هـا) در نمونه ای از یک محلول مولار یا نرمال ، باید غلظت محلول را در حجم آن (برحسـب لیتـر) ضـرب کـرد. برای مثال در یک محلول 4 M برحسب تعریف، 4 مول ماده در یک لیتر از محلول حل شـده اسـت. 0.5 لیتر از این محلـول دارای 2مـول مـاده حـل شـده مـی باشـد. یعنـی حاصـل ضـرب حجـم در غلظـت 0.5 ×4 = 2 molبنابراین به طور کلی نتیجه می شود.
تعداد مولهای مــاده حل شده در نمونه = V × M
تعداد هم ارزهای ماده حل شده در نمونه = V × N
با توجه به اینکه همواره یک هم ارز اسید با یک هم ارز باز واکنش میدهد، پس خواهیم داشت :
meq acid = meq base
N acid (eq/L) × V(mL) acid = N base (eq/L) × V(mL) base
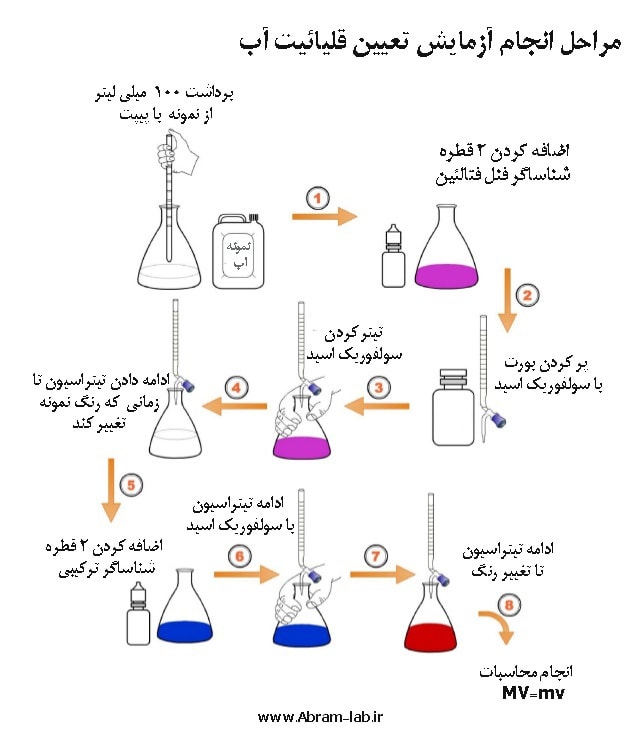
رابطه فوق اساس محاسبه مربوط به تيتراسيون ميباشد. محلولي كه داراي نرماليته مشخص است، محلول استاندارد يا محلول تيتركننده و يا محلول معلوم و محلولي كه داراي نرماليته نامشخص ميباشد محلول تيتر شدني يا محلول مجهول ناميده ميشود. معمولا محلول استاندارد را در بورت و محلول مجهول را در ارلن ماير (Erlen meyer) ميريزند و نقطه پايان واكنش به وسيله يك شناساگر مناسب تعيين ميشود. (نرمالیته یک محلول برابراست با اکی والان گرم ماده حل شده در یک لیتر محلول)
بر اساس روش کار تیتراسیون براي برداشتن محلول مجهول معمولا از پيپت استفاده ميشود. پس حجم محلول مجهول در هر سنجش برابر حجم پيپت (Pipette) خواهد بود. در پايان سنجش، حجم محلول استاندارد مصرف شده از روي بورت (Burette) خوانده ميشود.
نرماليته محلول استاندارد معلوم است به اين ترتيب، در رابطه: N1.V1 = N2.V2 تنها نرماليته ماده مجهول نامعلوم است، كه به سادگي قابل محاسبه خواهد بود.
روش کار تیتراسیون در آزمایشگاه
- وسائل شيشهاي اندازهگيري بايد كاملا تميز باشند به طوري كه قطره هاي آب به ديواره هاي آنها نچسبیده باشد (چرب نباشد). در غير اينصورت آنها را با مايع پاك كننده بشوييد.
- در روش کار تیتراسیون براي اينكه بتوانيد يك محلول را چند بار تيتر كنيد، ابتدا محلول را در بالن ژوژه بريزيد. به آن آنقدر آب مقطر اضافه كنيد تا سطح محلول مقابل خط نشانه قرار گيرد. در آن را ببنديد و خوب به هم بزنيد تا محلول يكنواخت شود (حجم بالن ژوژه روي آن نوشته شده است). سپس ميتوانيد چندين بار حجمهاي معيني از آن را براي سنجش برداريد مقداري كه هر بار براي سنجش بر ميداريد جزء مشخصي از كل محلول است.
- پيش از ريختن محلول در بورت، بورت(Burette) را با كمي از خود محلول بشوييد (محلول شست و شو را دور بريزيد). تا قطره هاي آب به ديواره بورت باقي نماند.
- براي ريختن محلول در بورت از قيف استفاده كنيد.
- دقت كنيد روش کار تیتراسیون ، شير بورت چكه نكند، پس از ريختن محلول در بورت، زير شير آن پر باشد و حباب هوا در آن باقي نماند. در صورت وجود حباب، با باز و بسته كردن سريع شير بورت حباب را از بين ببريد.
- بورتهاي معمولي تا 0.1 mL مدرج شده است و شما مي توانيد تا 0.1 mL را با كمي تقريب بخوانيد و هنگام نوشتن حجم تا 0.1mL بنويسيد. (مثلاً0.15ميليليتر صحيح است نه 15 خالي).
- براي برداشتن محلول به وسيله پيپت در روش کار تیتراسیون ، ابتدا پيپت را با آب مقطر بشوييد، ديواره بيروني آن را به وسيله دستمال خشك كنيد. سپس داخل پيپت را با كمي از محلول مورد آزمايش بشوييد (محلول شست و شو را دور بريزيد). آنگاه سر پيپت را درون محلول قرار دهيد و به وسیله مكنده لاستيكي (Pipette Filler) آنرا پر کنید. در ادامه نوک پيپت را مدتي(تقريبا 20 ثانيه ) به بدنه ارلن تكيه دهيد تا مایع درون آن خارج شود. (مقدار بسيار جزئي از محلول كه در سر پيپت باقي مي ماند، حساب شده است، بنابراين هرگز در پيپت ندميد و آن را نتكانيد).
- براي برداشتن محلولهايي كه در واكنش شركت ميكنند، ولي مقدارشان در محاسبه وارد نميشود از استوانه مدرج استفاده كنيد.
- محلول شناساگر يا مواد ديگر لازم براي انجام واكنش را، به محلول مجهول، در ارلن بيفزاييد.
- خط مدرج مقابل سطح محلول درون بورت را يادداشت كنيد. ( V1 )
- براي خواندن سطح محلول در امتداد سطح افق به بورت يا پيپت نگاه كنيد و خطي را بخوانيد كه به زير منحني سطح محلول مماس است.
- در روش کار تیتراسیون ، يك صفحه كاغذ سفيد زير ارلن بگذاريد تا تغيير رنگ را به خوبي تشخيص دهيد.
- شير بورت را با دست چپ و گردن ارلن را با دست راست بگيريد. ارلن را زير شير بورت نگهداريد. شيربورت را به آرامي باز كنيد و از محلول درون بورت، به تدريج، به محلول مجهول درون ارلن بيفزاييد. در تمام مدت تيتراسيون (در مدتي كه محلول معلوم را به محلول مجهول اضافه مي كنيد) بايد محلول را به كمك حركت چرخشي كه با دست به ارلن ميدهيد به هم بزنيد. به محض مشاهده تغيير رنگ گفته شده در هر آزمايش شير بورت را ببنديد.
- ببينيد سطح مايع در بورت مقابل كدام خط نشانه است. آن را يادداشت كنيد( V2 ).
- با كم كردن حجمهاي خوانده شده از روي بورت (در ابتدا و پايان تيتراسيون) حجم محلول معلوم مصرف شده را به دست آوريد (V= V2 – V1 ).
- اگر محلول مجهول كافي را در اختيار داريد ابتدا يك بار تيتراسيون را سريع انجام دهيد تا حدود حجم معلوم مصرفي را به دست آوريد و سپس با دانستن اين مقدار، بار دوم با دقت زيادي تيتراسيون را سريع انجام دهيد تا حدود حجم معلوم مصرفي را به دست آوريد و سپس با دانستن اين مقدار، بار دوم با دقت زيادتري تيتراسيون را تكرار كنيد.
- در روش کار تیتراسیون بهتر است که در صورتي كه چند بار تيتراسيون را انجام دادهايد و رقمهاي نزديك به هم به دست آوردهايد ميتوانيد حجمهاي مصرفي را ميانگين بگيريد.