روشهای اندازهگیری کربن دیاکسید در آب
روشهای اندازهگیری کربن دیاکسید در آب
روشهای مختلفی برای اندازهگیری کربن دیاکسید در آب وجود دارد که در پایین به آنها اشاره شده است. میزان کربن دیاکسید آزاد در آبهای سطحی به طور معمول کمتر از 10 ppm میباشد، این در حالی است که در آب چاهها مقادیر بیشتری از این ترکیب وجود دارد. کربن دیاکسید از طریق جو، فعالیت موجودات زنده و تجزیه گرمایی سنگهای کربناته وارد آب میشود. از آنجا که حضور CO2 سبب خورندگی میشود بایستی میزان آن در آب مشخص شود.

روشهای اندازهگیری کربن دیاکسید
روشهای نُموگرافی[1] و تیتراسیون پتانسیومتری و تیتراسیون اسید – باز با شناساگر فنولفتالئین از روشهای اندازهگیری کربن دیاکسید در آب آزاد در آب آشامیدنی میباشند. اگر تیتراسیون با شناساگر به طور صحیح انجام شود، یک روش سریع، آسان و با نتیجه رضایت بخش در کنترل کیفیت آب خواهد بود.
با مشخص بودن pH، قلیائیت کل، دما و کل مواد معدنی در لحظه نمونهبرداری، روش نُموگرافی برای محاسبه سریع یون هیدروکسید، بیکربنات، کربنات و مقدار کل کربن دیاکسید آزاد در آبهای طبیعی و تصفیه شده مناسب میباشد. برای استفاده از روش نُموگرافی به نمودارهای زیر و راهنمای استفاده از آنها توجه کنید. این نمودارها زمانی قابل استفاده هستند که نمک اسیدهای ضعیف در مقایسه با نمک اسید کربنیک ناچیز باشند. باید توجه داشت که نمودارهای ذکر شده در فرآیندهای تصفیه مانند انعقاد و سوپرکلرزنی[2] که باعث تغییر pH و قلیائیت کل میشوند، قابل استفاده نخواهد بود. نُموگرافها براساس روابط تعادلی کربنات و آب تهیه شدهاند.
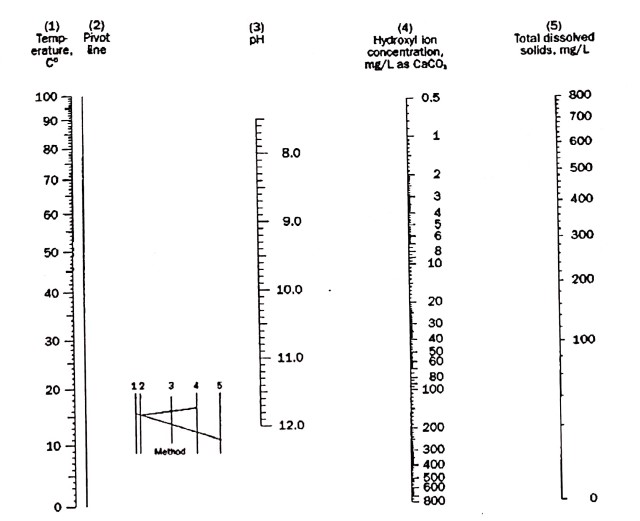
نُموگراف تعیین غلظت یون هیدروکسید
راهنمای استفاده: دو خط دما (مقیاس 1) و کل جامدات محلول (مقیاس 5) را به هم وصل کنید. از محل برخورد خط رسم شده با شماره 2، نقطهای به دست میآید. از این نقطه به سمت خط pH (مقیاس 3) یک خط دیگر رسم نمایید. از محل برخورد خط رسم شده با مقیاس 4، غلظت یون هیدروکسید برحسب ppm CaCO3 به دست میآید.

نُموگراف تعیین قلیائیت بیکربنات
راهنمای استفاده: دو خط دما (مقیاس 1) و کل مواد جامد محلول (مقیاس 3) را به هم وصل کنید. از محل برخورد خط رسم شده با خط شماره 2، نقطهای بهدست میآید. از این نقطه به سمت خط pH (مقیاس 4) یک خط دیگر رسم نمایید. از امتداد خط روی مقیاس 5، عدد ثابتی بهدست میآید. این عدد را روی مقیاس 6 قرار دهید. قلیائیت هیدروکسیدی را از نُموگراف هیدروکسید بهدست آورید و از قلیائیت کل کم کنید (قلیائیت غیرهیدروکسیدی). عدد مقیاس 6 را به قلیائیت غیرهیدروکسیدی (مقیاس 7) وصل کنید. از محل برخورد خط رسم شده با مقیاس 8، غلظت یون بیکربنات بر حسب ppm CaCO3 به دست میآید.
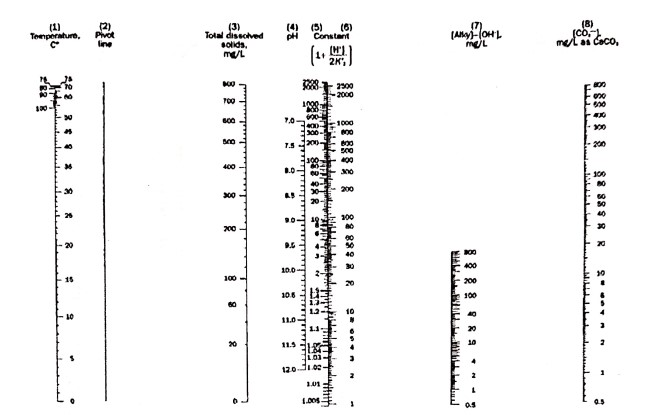
نُموگراف تعیین قلیائیت کربنات
راهنمای استفاده: دو خط دما (مقیاس 1) و کل مواد جامد محلول (مقیاس 3) را به هم وصل کنید. از محل برخورد خط رسم شده با خط شماره 2، نقطهای به دست میآید. از این نقطه به سمت خط pH (مقیاس 4)یک خط دیگر رسم نمایید. از امتداد خط روی مقیاس 5، عدد ثابتی به دست میآید. این عدد را روی مقیاس 6 قرار دهید. قلیائیت هیدروکسیدی را از نُموگراف هیدروکسید به دست آورید و از قلیائیت کل کم کنید(قلیائیت غیر هیدروکسیدی). از محل برخورد خط رسم شده با مقیاس 8، غلظت یون کربنات بر حسب ppm CaCO3 به دست میآید.

نُموگراف تعیین کربن دیاکسید آزاد
راهنمای استفاده: دو خط دما (مقیاس 1) و کل جامدات محلول (مقیاس 3) را به هم وصل کنید. از محل برخورد خط رسم شده با خط شماره 2، نقطه p1 به دست میآید. عدد pH (مقیاس 4) را به عدد قلیائیت بیکربناتت (مقیاس 7) وصل کنید. از محل برخورد خط رسم شده با خط شماره 6، نقطه P2 به دست میآید. دو نقطه P1 و P2 را به هم وصل کنید. از محل برخورد خط رسم شده با مقیاس 5، غلظت کربن دیاکسید آزاد بر حسب ppm به دست میآید.
در روش تیتراسیون، CO2 آزاد با یک باز استاندارد مانند سدیم کربنات یا سود واکنش مینماید. نقطه پایان واکنش به دو روش پتانسیومتری یا ایجاد رنگ ارغوانی فنولفتالئین در pH بالای 8/3 مشخص میشود. اگر تشخیص نقطه پایان دشوار است، بایستی از تیتراسیون پتانسیومتری استفاده نمود.
استاندارد نمودن تیترانت، پیش از انجام آزمایش، ضروری است. برای استاندارد نمودن سدیم هیدروکسید از محلول 0/05 N پتاسیم هیدروژن فتالات (n=1 eq/1mol) استفاده میشود. برای محاسبه نرمالیته سود از فرمول زیر استفاده نمایید.

براساس حجم مصرف شده از تیترانت و pH اولیه، غلظت کربن دیاکسید بر حسب ppm قابل محاسبه خواهد بود:

اگر از آب مقطر به عنوان شاهد استفاده میشود، حجم مصرف شده تیترانت برای شاهد (Vtitrant for blank) و نمونه مجهول (Vtitrant) را ثبت نمایید. حجم به دست آمده برای شاهد را از حجم به دست آمده برای نمونه کم نموده (Vtitrant – Vtitrant for blank) و در محاسبه قرار دهید.
تداخلها: کاتیونها و آنیونهایی که سبب تداخل در تعادل طبیعی بین CO2 – کربنات میشوند، از جمله مزاحمهای اندازهگیری محسوب میشوند. کاتیونهایی مانند Al3+، Fe3+، Cr3+، Fe2+ و Cu2+ که در محیط قلیایی رسوب میدهند، سبب خطای مثبت میشوند. به طور مثال، غلظت یون Fe2+ نباید از 1/0 ppm بیشتر باشد. خطای مثبت میتواند ناشی از حضور بازهای ضعیف مانند آمونیاک (NH3) و آمینها (NRH2)، نمک اسیدهای ضعیف مانند بورات (BO33-)، نیتریت (NO2–)، فسفات (PO43-)، سیلیکات (SIO44-) و سولفید (S2-) باشد. روش تیتراسیون برای نمونههایی که دارای پساب اسیدی معدن و محلول شستشوی اسیدی رزین کاتیونی هستند مناسب نمیباشد. زمانی که مقدار کل مواد جامد محلول (TDS) یا مقدار شناساگر زیاد باشد، خطای منفی ایجاد میشود.
نمونهبرداری و نگهداری:
همواره احتمال از دست دادن مقداری از CO2 آزاد در هنگام نمونهبرداری و نگهداری وجود دارد. به ویژه اگر مقدار گاز در نمونه زیاد باشد. بنابراین بهتر است بلافاصله بعد از نمونهبرداری، اندازهگیری صورت گیرد. اگر بین نمونهبرداری و اندازهگیری فاصله زمانی وجود دارد، باید نمونه در دمایی پایینتر از دمای اصلی نمونه نگهداری شود.
محاسبه غلظت کربن دیاکسید براساس pH و قلیائیت کل
اگر قلیائیت ناشی از یونهای هیدروکسسید، کربنات و یا بیکربنات و دما °C 25 بوده و TDS از مقدار 500 ppm بیشتر نباشد، با داشتن مقادیر pH و قلیائیت کل (M) میتوان کربن دیاکسید آزاد (free, ppm[CO2]) و کل (total, ppm[CO2]) را محاسبه نمود:

شایان ذکر است که معادلات فوق، براساس ثابت های تفکیک اسیدی استخراج شدهاند:

[1] nomographic method
[2] superchlorination